Cartilla de la quimioterapia: ¿Por qué? ¿Qué? ¿y cómo?
encontrar mi
Una nota especial al lector: todas las drogas de quimioterapia discutidas adjunto se pueden encontrar en OncoLinkRx.
Historia de la quimioterapia
Quimioterapia, o el uso de agentes químicos para destruir las células de cáncer, es un sostén principal en el tratamiento de malignidades. El papel posible en tratar la enfermedad fue descubierto cuando el efecto represivo de la médula ósea de la mostaza del nitrógeno fue observado en los tempranos 1900's. Desde ese tiempo, la búsqueda para drogas con actividad anticáncer ha continuado, y la meta del tratamiento con quimioterapia se ha desarrollado de la relevación de síntomas a la curación del cáncer. Una ventaja importante de la quimioterapia es su capacidad de tratar el cáncer extenso o metastático, mientras que la cirugía y la radioterapia se limitan a tratar los cánceres que se confinan a áreas específicas.
¿Cómo trabajan las drogas de la quimioterapia?
El objeto de todas las drogas de la quimioterapia es matar a las células cancerosas y no dañar las células sanas adyacentes. Para llegar a esta meta, los científicos intentaron identificar las características que son únicas a las células de cáncer y no se encuentran en el tejido fino normal. Una característica distinta de cáncer podía servir como un blanco potencial para una droga de quimioterapia y de tal modo reserva el tejido normal. Una característica que es verdaderamente única para la mayoría de las células de cáncer es que crecen en una tarifa más rápida que las células normales. Por lo tanto apuntar un cierto aspecto del ciclo de crecimiento de la célula parece razonable. Las células de crecimiento rápido serían afectadas la mayoría y las células de crecimiento lento serían disturbadas lo más menos posible. De hecho, ésa es la base para muchos quimioterapéuticos. Esto parece obvio cuando se consideran los perfiles de efectos secundarios de la mayoría de las drogas de quimioterapia. Los folículos del pelo, la piel, y las células que alinean el aparato gastrointestinal son algunas de las células de mayor crecimiento del cuerpo humano, y por lo tanto son las más sensibles a los efectos de la quimioterapia. Es por esta razón que los pacientes pueden experimentar pérdida del pelo, erupciones de la piel y diarrea, respectivamente.
El cuerpo humano procesa y excreta todas las drogas a través del hígado o de los riñones. Por lo tanto, cuando un paciente tiene daño en el riñón o en el hígado, dar la quimioterapia llega a ser precario. Administrar la cantidad recomendada de droga puede demostrar ser demasiado tóxico en un paciente incapaz de metabolizarla y excretarla. Los farmacocinéticos para los pacientes del cáncer son muy complejos y la farmacología de la quimioterapia es una sub-especialidad en sí misma. Desdichadamente, daño al riñón y al hígado es un resultado común debido a la invasión del cáncer, limitando las opciones de quimioterapia del paciente.
Los farmacocinéticos se complican más a fondo en el paciente del cáncer, pues están tomando a menudo medicaciones múltiples, algunas de las cuales tienen caminos metabólicos y perfiles de efectos secundarios traslapados. Un ejemplo de esta situación difícil es en el paciente con cáncer del cerebro. Porque los tumores del cerebro a menudo se presentan como convulsiones, muchos de estos pacientes toman medicaciones contra las convulsiones. Las medicaciones contra las convulsiones son metabolizadas por el hígado y afectan el metabolismo de muchas drogas de quimioterapia. Los ajustes de la dosis son una necesidad absoluta para evitar toxicidades o dosificación sub-terapéutica (dosis que son muy bajas) en estos pacientes.
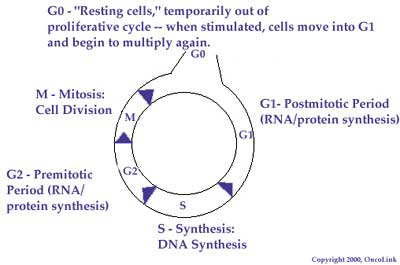
El ciclo de la célula
Entender el ciclo de la célula normal y el comportamiento de las células malignas o cancerosas puede llevar al conocimiento mejor de cómo la quimioterapia trabaja para destruir las células del cáncer. El ciclo de la célula es la secuencia de pasos que una célula va a través para copiar su material genético y dividirse en dos células. El ciclo de la célula está formado en cuatro fases, fases de G1, S, G2, y M. Un agente de la quimioterapia puede trabajar en solamente una fase del ciclo (llamado ciclo de célula específico) o ser activo en todas las fases (ciclo de célula no específico).
La fase de G1 es la fase más activa en la síntesis de la proteína. El ADN celular en esta fase esta arrollado firmemente y no se está transcribiendo activamente. Pocos agentes de quimioterapia son activos en esta fase del ciclo de la célula. Por el contrario, la fase S es la fase sintética del ciclo de la célula. La réplica del ADN es la más activa y muchos agentes quimioterapéuticos son los más activos en esta fase. G2 representa una época en la cual sobre todo la ARN (y un poco la proteína) se produce activamente. La mitosis, o la división de la célula actual, ocurre durante la fase M. Hay dos clases mayores de drogas de quimioterapia que son las más activas durante esta fase del ciclo de la célula. Sabiendo la fase en la cual un agente trabaja, podemos combinar los agentes que trabajan en diversas fases para alcanzar la mayoría de la matanza del tumor.
Agentes quimioterapéuticos
La mayoría de los agentes de la quimioterapia matan a las células del cáncer afectando la síntesis o la función del ADN, un proceso que ocurre durante el ciclo de la célula. Cada droga varía de la manera en que esto ocurre dentro del ciclo de la célula.
Las categorías principales de los agentes de la quimioterapia son los agentes alquilantes, los antimetabolitos, los antraciclinos, los alcaloides de la planta, los antibióticos antitumor, los taxanos, y los platinos. Repasemos las características de estos grupos.
Agentes alquilantes
Los Agentes Alquilantes son la clase más vieja de drogas anticáncer. Casi todas estas drogas son mostazas del nitrógeno activas o latentes. Las mostazas del nitrógeno son varios compuestos venenosos desarrollados originalmente para el uso de los militares. Todos los agentes alquilantes comparten un mecanismo de acción común pero se diferencian en su actividad clínica. Trabajan atacando los sitios negativamente cargados en el ADN (átomos del oxígeno, nitrógeno, fósforo y sulfuro). Atando al ADN, los pasos (réplica, transcripción e incluso el apareamiento de las bases) llevando a la duplicación del material genético son alterados perceptiblemente. Además, alquilizacion del ADN también conduce a roturas del filamento del ADN y ligadura cruzada del filamento del ADN. Alterando el ADN de este modo, la actividad celular es parada con eficacia y la célula morirá. Las drogas de la quimioterapia en esta clase son activas en cada etapa del ciclo de la célula. Por consiguiente, esta clase de drogas anticáncer es de muy gran alcance y se utiliza en la mayoría de cada tipo de cáncer ambos tumores sólidos y leucemia.
En general, el uso prolongado de estas drogas conducirá a la producción disminuida de la esperma, cesación de la menstruación, y causa posiblemente infertilidad permanente. Esta clase de quimioterapéutico nunca se debe utilizar en el primer trimestre del embarazo puesto que se demuestra aumentar malformaciones fetales. El uso en el segundo o tercer trimestre no parece llevar el mismo riesgo. Todos los agentes alquilantes pueden causar cánceres secundarios aunque no todos los agentes son iguales en su poder carcinogénico. El cáncer secundario más común es la leucemia (leucemia mieloide aguda o AML, por sus siglas en ingles) que puede ocurrir años después de la terapia.
Algunos de los agentes alquilantes más comunes incluyen: Cyclophosphamide, Ifosfamide, Melphalan, Chlorambucil, BCNU, CCNU, Dacarbazine, Procarbazine, Busulfan, y Thiotepa.
Antimetabolitos
En 1948, el Dr. Sidney Farber demostró que un análogo del ácido fólico podría inducir la remisión en la leucemia de la niñez. Aproximadamente 10 fuera de 16 pacientes tratados demostraron evidencia de mejoría hematológica. Esta experiencia proporcionó la fundación para los científicos sintetizar un número de otros agentes que o apuntan los compuestos naturales o inhiben las reacciones enzimáticas dominantes en sus caminos bioquímicos. Generalmente todos los antimetabolitos interfieren con los caminos metabólicos normales, incluyendo ésos necesarios para hacer el ADN nuevo. El antifolico más ampliamente utilizado en la terapia del cáncer con actividad contra la leucemia, linfoma, cáncer del seno, cáncer de la cabeza y del cuello, los sarcomas, cáncer del colon, cáncer de la vejiga y los coriocarcinomas es Methotraxate . Methotraxate inhibe una enzima crucial requerida para la síntesis del ADN y por lo tanto ejerce su efecto sobre la fase S del ciclo de la célula.
5-Fluorouracil (5-FU), otro antimetabolito ampliamente utilizado, previene la síntesis del ADN interfiriendo con la producción del nucleótido (componentes del ADN). Este tiene también una amplia gama de actividad incluyendo contra el cáncer del colon, cáncer del seno, cáncer de la cabeza y del cuello, cáncer pancreático, cáncer gástrico, cáncer anal, cáncer del esófago y hepatomas (cáncer del hígado primario). Un aspecto único e interesante de esta droga es su perfil de toxicidad. 5-Fluorouracil es metabolizado por una enzima natural llamada él deshidrogenase del dihidropirimidino, DPD. Hay una población pequeña de gente que puede ser deficiente de esta enzima particular. Carecer DPD no interfiere con la bioquímica normal del cuerpo y el fenotipo es así silencioso. Sin embargo, cuando tratan a estos pacientes con esta droga de quimioterapia, no pueden metabolizarla y por lo tanto desarrollan una toxicidad (efectos secundarios) aguda y severa. Las toxicidades más comúnmente vistas incluyen la supresión de la médula, toxicidades severas del sistema gastroenterólogo, y las neurotoxicidades que pueden incluir convulsiones e incluso una coma. Es importante que el oncólogo reconozca esto temprano y provea al paciente con Thymidine como antídoto. Una droga llamada Capecitabine es un compuesto oral del 5-Fluorouracil que tiene potenciales de efectos secundarios similares.
Otros antimetabolitos que inhiben síntesis del ADN y la reparación del ADN incluyen: Cytarabine, Gemcitabine ( Gemzar ®), 6 mercaptopurine, Thioguanine, Fludarabine, y Cladribine.
Antraciclinos
Muchas de las drogas anticáncer actualmente eficaces son de fuentes naturales. La droga, daunorubicin fue aislada de las Streptomices, un hongo que vive en la tierra. Doxorubicin, otra droga antraciclina, fue aislada de un rasgo mutado del mismo hongo. Ambas drogas tienen un mecanismo similar de acción, pero el último es más eficaz en el tratamiento de carcinomas. Esta clase de quimioterapéutico trabaja por la formación de los radicales libres del oxígeno. Estos radicales dan lugar a roturas del filamento del ADN y a la inhibición subsiguiente de la síntesis y de la función del ADN. Los antraciclinos también inhibe el topoisomerase de la enzima formando un complejo con la enzima y el ADN. Topoisomerases es una clase de enzimas que sirven para desenrollar la hélice doble del filamento del ADN para permitir la reparación, réplica y transcripción del ADN. Esta clase de quimioterapéutico no es también específico al ciclo de la célula. El efecto secundario más importante de este grupo de drogas es toxicidad cardiaca. Los mismos radicales libres que sirven para dañar el ADN de la célula de cáncer pueden dañar las células del músculo del corazón. Los oncólogos monitorean la función del corazón muy cuidadosamente cuando los pacientes están recibiendo estas medicaciones. Otros antraciclinos de uso general incluyen Idarubicin, Epirubicin, and Mitoxantrone.
Antibióticos antitumor
Otro quimioterapéutico aislado del hongo Verticullus de los Streptomyces es el Bleomycin. Su mecanismo de acción es similar al de los antraciclinos, en que los radicales libres del oxígeno son formados que dan lugar a las roturas del ADN que conducen a la muerte de la célula de cáncer. Esta droga es utilizada raramente por sí misma pero sí en conjunción con otras quimioterapias. El Bleomycin es un agente activo en el régimen para el cáncer testicular así como el linfoma de Hodgkin. El efecto secundario de mas concierne de esta droga son toxicidades del pulmón debido a la formación de radicales libres de oxígeno.
Alcaloides de la planta
Los alcaloides de la planta son un grupo de agentes de la quimioterapia derivados de los materiales de planta. Se analizan en cuatro grupos: inhibidores del topoisomerase, epipodofilotoxinas, taxanos y alcaloides del vinca. Los alcaloides de la planta son específico al ciclo de la célula, pero el ciclo afectado varía de droga a droga.
Los análogos de Camptothecan (también llamados los inhibidores de Topoisomerase I) actúan formando un complejo con Topoisomerase y el ADN dando por resultado la inhibición y la función de la enzima del Topoisomerase. La presencia de Topoisomerase se requiere para la síntesis en curso del ADN. Estas drogas se utilizan en muchos tumores sólidos y líquidos. Desemejante de otras clases de quimioterapia, los efectos secundarios de esta clase de drogas varían de droga a droga.
Camptothecins incluyen ambos irinotecan y topotecan. El compuesto pariente de estos agentes, primero identificado en los últimos años 50, es un alcaloide natural encontrado en la corteza y la madera del árbol chino accuminata de Camptotheca, también llamado el "árbol feliz".
Etoposide y Teniposide son los agentes de la quimioterapia del epipodofilotoxina (también llamados los inhibidores del topoisomerase II) que trabajan por mecanismos similares. Se aíslan de la planta de May Apple y trabajan en las ultimas etapas de las fases S y G 2.
Las hojas de una planta del periwinkle, rosea de Vinca, fueron utilizadas por los naturales de Madagascar para hacer té que según se informa mejoran la diabetes. Aunque no afectó los niveles de azúcar de sangre en estudios de investigación, fue encontrado que el extracto mató a las células encontradas en leucemias. El aislamiento y la caracterización química conducen a las drogas de la quimioterapia actualmente usadas: vincristine, vinblastine, y vinorelbine. Estos quimioterapéuticos se atan al tubulin y conducen a la interrupción del aparato mitótico del aparato huso. La interrupción de la mitosis implica que estas drogas son activas específicamente durante la fase M del ciclo de la célula. Tienen un uso amplio en muchas diversas malignidades y causan neutoroxicidades como el efecto secundario más prominente y el que limita la dosis.
Taxanos
Otra clase de quimioterapéuticos que es específico para la fase M del ciclo de la célula son los taxanos. Los taxanos incluyen el paclitaxel y docetaxel. Se atan con alta afinidad a los microtubulos e inhiben su función normal. Esta clase de droga tiene una amplia gama de actividad clínica incluyendo cáncer del seno, cáncer del pulmón, cáncer de la cabeza y del cuello, cáncer ovárico, cáncer de la vejiga, cáncer del esófago, cáncer gástrico y cáncer de la próstata. El efecto secundario más común de esta droga es el bajar las células de sangre. Estos compuestos primero fueron aislados de la corteza del árbol del tejo pacífico Brevifolia del Taxus en 1963. No fue hasta el 1971 que el paclitaxel fue identificado como el componente activo y el 1993 cuando estaba disponible para uso.
Platinos
Los derivados naturales de metal también fueron demostrados de tener cierta actividad en la lucha contra el cáncer. Estos agentes trabajan cruz-ligando las subunidades del ADN. (El cruz-ligar puede suceder entre dos filamentos o dentro de un filamento de ADN.) La reticulación resultante actúa para inhibir la síntesis, transcripción y función del ADN. Los compuestos del platino pueden actuar en cualquier ciclo de la célula. Cisplatino se utiliza lo más menudo posible en cáncer del pulmón y cáncer testicular. La toxicidad más significativa del cisplatino es daño al riñón. El platino de segunda generación, llamado carboplatino, tiene pocos efectos secundarios al riñón, y ocasionalmente puede ser un substituto apropiado para los regimientos que contienen cisplatino. Oxaliplatino es un platino de tercera-generación que es activo en el cáncer del colon y no tiene ninguna toxicidad renal (del riñón), sin embargo, puede causar neuropatías severas.
Agentes misceláneos de la quimioterapia
Ciertos tipos de quimioterapéuticos son drogas huérfanas, significando que no hay otras como ellas. Los ejemplos de agentes misceláneos incluyen: L-asparaginase, hydroxyurea, thalidomide y dactinomycin.
Administración de la quimioterapia
Las rutas de la administración más comunes para la quimioterapia son por vía oral, a través de una vena, y en un músculo. Más recientemente, otros métodos se han utilizado para aumentar la concentración local de la quimioterapia en el sitio del tumor. La quimioterapia se puede administrar directamente en una cavidad específica (intracavitaria), el abdomen (intraperitoneal), el pulmón (intrapleural), el sistema nervioso central (intratecal), o aplicar directamente a la piel (tópica).
Porque muchos agentes quimioterapéuticos también afectan las células y los órganos sanos, los datos del laboratorio del paciente se deben comprobar antes de la administración de la quimioterapia, incluyendo la cuenta de la célula de sangre blanca, hemoglobina/hematocrito, cuenta de plaqueta, pruebas de función renales, y la prueba de función hepática. Además, el gravamen para los efectos específicos del órgano de la droga será realizado sobre una base periódica. Las anormalidades en alguno de estos valores pueden requerir ajustes de la dosis o retraso de la terapia. Además, las acciones del tratamiento previo, tales como líquidos suplemental o administración intravenosa de las medicinas contra la náusea pueden ser necesarias para disminuir los efectos secundarios.
Estrategias de la administración de la quimioterapia
La quimioterapia de combinación combina los agentes que diferencian en ambos la manera que actúan y sus efectos secundarios. Esto se hace para alcanzar efecto máximo al tumor con efectos secundarios mínimos. Porque las células del tumor tienen diversas características biológicas (heterogeneidad), combinar las drogas puede eliminar con eficacia la capacidad de las células del cáncer de ganar resistencia a un solo agente. Dando ciclos múltiple de quimioterapia, durante meses, en intervalos específicos (es decir, cada 3 semanas, semanalmente), la quimioterapia puede destruir las células del tumor mientras que permite tiempo para que las células normales del paciente se sanen.
Quimioterapia ayudante Quimioterapia adyuvante (quimioterapia dada después de la cirugía) se utiliza de este modo para disminuir el riesgo de que el cáncer regrese. Esto se hace aun cuando no hay alguna evidencia clara del cáncer encontrada, solamente ciertos factores (por ejemplo, la metástasis a los ganglios linfáticos, el tamaño grande del tumor) que predicen un riesgo creciente de la recurrencia del cáncer.
Quimioterapia neoadyuvante (quimioterapia dada antes de la cirugía) se utiliza de este modo para contraer un tumor antes de la cirugía, que puede permitir que el cirujano realice una cirugía más pequeña y/o quite todo el tumor visible.
Quimioterapia de modalidad combinada es la práctica de usar la quimioterapia conjuntamente con otras modalidades del tratamiento, tales como radiación o cirugía. Las terapias se combinan para obtener una mayor tasa de respuesta que podría ser alcanzada con una sola modalidad del tratamiento. Hoy, usar más de una modalidad del tratamiento es común para la mayoría de los cánceres.
Manipulación hormonal no mata directamente a las células y, por lo tanto, no es curativa. Su propósito es prevenir la división de la célula y el crecimiento adicional de tumores dependientes de hormonas. Su uso se reserva con frecuencia para la gerencia de pacientes con el cáncer localmente avanzado o metastático. Visite sección de la terapia hormonal para más información.
Terapia de investigación
La identificación y el desarrollo de drogas anticáncer nuevas y eficaces es un proceso en curso. Después de prueba rigurosa en animales de laboratorio y sistemas de modelo experimentales, los agentes de la quimioterapia con actividad antitumor demostrada se evalúan con el uso de estudios clínicos. En estudios de la fase I, la fase inicial de la investigación clínica, un nuevo tratamiento se evalúa en pacientes del cáncer por primera vez. El propósito de éstos estudios es determinar los efectos secundarios asociados, la dosis más alta tolerada con seguridad, y el horario o el modo óptimo de la entrega de una terapia nueva. Los estudios de la fase II prueban una nueva terapia (que usa la dosis, el método de administración, y el horario definido en la fase I) en pacientes con una variedad de tumores para determinar si hay actividad antitumor identificable. En estudios de la fase III, las nuevas terapias que exhibieron actividad en la fase II se comparan en números más grandes de pacientes a la terapia disponible estándar o mejor para cada tipo de tumor probado.
Participación en un estudio clínico es una opción del tratamiento, que se puede ofrecer a los pacientes en un cierto punto durante su terapia. El progreso continuo del tratamiento del cáncer depende de la participación de números adecuados de pacientes en tales estudios.