Instituto Nacional del Cáncer
encontrar mi
Fecha de publicación: Dec 3, 2023
Información sobre el cáncer gástrico difuso hereditario (HDGC) y su tratamiento. Este síndrome hereditario de riesgo de cáncer gástrico está causado por alteraciones en los genes CDH1 y CTNNA1. Resumen para profesionales de la salud.
Cáncer gástrico difuso hereditario
Introducción
El cáncer gástrico difuso hereditario (HDGC) es un síndrome de cáncer hereditarioautosómico dominante que aumenta el riesgo de cáncer gástrico difuso y cáncer de mama lobulillar. El HDGC se define por la presencia de variantes patogénicas de la línea germinal en el genCDH1 que codifica la proteína de adhesión intercelular cadherina E. En portadores de variantes patogénicas de CDH1, el riesgo de por vida de cáncer gástrico difuso (hasta los 80 años) oscila entre el 37 % y el 70 % en hombres y entre el 25 % y el 83 % en mujeres. La edad promedio del diagnóstico de cáncer gástrico oscila entre 38 y 80 años; el diagnóstico más temprano notificado ocurrió a los 14 años. El riesgo de por vida de cáncer de mama lobulillar (hasta los 80 años) oscila entre el 39 % y el 55 % en mujeres portadoras de una variante patogénica en el gen CDH1. La edad promedio del diagnóstico de cáncer de mama lobulillar oscila entre 46 y 50 años. Las estimaciones recientes sobre el riesgo de cáncer de mama gástrico y lobulillar son incluso más bajas que estas cifras porque los criterios clínicos para las pruebas genéticas son cada vez menos estrictos. Este fenómeno también se ha observado con otros síndromes de cáncer hereditario, como el cáncer hereditario de mama y ovario y el síndrome de Lynch.
En un número pequeño de familias con HDGC, se encuentran variantes patogénicas de otro gen, el CTNNA1. Este gen codifica la proteína de adhesión catenina α E. La edad de aparición del cáncer gástrico en los portadores confirmados de variantes patogénicas en el gen CTNNA1 oscila entre 22 y 72 años, pero se desconoce la penetrancia del cáncer gástrico en estas personas. Además, no está claro si las variantes patogénicas del gen CTNNA1 aumentan el riesgo de cáncer de mama. Dado el poco conocimiento sobre la prevalencia y la penetrancia de las variantes patogénicas en el gen CTNNA1, muchos laboratorios comerciales no ofrecen pruebas genéticas clínicas para este gen.
References
- Pharoah PD, Guilford P, Caldas C, et al.: Incidence of gastric cancer and breast cancer in CDH1 (E-cadherin) mutation carriers from hereditary diffuse gastric cancer families. Gastroenterology 121 (6): 1348-53, 2001.
- Roberts ME, Ranola JMO, Marshall ML, et al.: Comparison of CDH1 Penetrance Estimates in Clinically Ascertained Families vs Families Ascertained for Multiple Gastric Cancers. JAMA Oncol 5 (9): 1325-1331, 2019.
- Xicola RM, Li S, Rodriguez N, et al.: Clinical features and cancer risk in families with pathogenic CDH1 variants irrespective of clinical criteria. J Med Genet 56 (12): 838-843, 2019.
- Hansford S, Kaurah P, Li-Chang H, et al.: Hereditary Diffuse Gastric Cancer Syndrome: CDH1 Mutations and Beyond. JAMA Oncol 1 (1): 23-32, 2015.
- Delgado E, León-Ponte M, Villahermosa ML, et al.: Analysis of HIV type 1 protease and reverse transcriptase sequences from Venezuela for drug resistance-associated mutations and subtype classification: a UNAIDS study. AIDS Res Hum Retroviruses 17 (8): 753-8, 2001.
- Caldas C, Carneiro F, Lynch HT, et al.: Familial gastric cancer: overview and guidelines for management. J Med Genet 36 (12): 873-80, 1999.
- Corso G, Intra M, Trentin C, et al.: CDH1 germline mutations and hereditary lobular breast cancer. Fam Cancer 15 (2): 215-9, 2016.
- van der Post RS, Vogelaar IP, Carneiro F, et al.: Hereditary diffuse gastric cancer: updated clinical guidelines with an emphasis on germline CDH1 mutation carriers. J Med Genet 52 (6): 361-74, 2015.
- Majewski IJ, Kluijt I, Cats A, et al.: An α-E-catenin (CTNNA1) mutation in hereditary diffuse gastric cancer. J Pathol 229 (4): 621-9, 2013.
- Benusiglio PR, Colas C, Guillerm E, et al.: Clinical implications of CTNNA1 germline mutations in asymptomatic carriers. Gastric Cancer 22 (4): 899-903, 2019.
- Clark DF, Michalski ST, Tondon R, et al.: Loss-of-function variants in CTNNA1 detected on multigene panel testing in individuals with gastric or breast cancer. Genet Med 22 (5): 840-846, 2020.
Criterios para las pruebas genéticas del cáncer gástrico difuso hereditario
A continuación se resumen las directrices para las pruebas genéticas del cáncer gástrico difuso hereditario (HDGC) del International Gastric Cancer Linkage Consortium (IGCLC) de 2020. Es posible obtener pruebas genéticas del gen CDH1 cuando una persona cumple los requisitos para las pruebas genéticas de HDGC según el IGCLC y cuando se cumplen los criterios de antecedentes personales o de historia familiar que se indican a continuación. Se recomienda confirmar todo diagnóstico de cáncer y el tipo histológico en el probando y en sus familiares usando registros médicos apropiados. Además, cuando alguno de los elementos que se indican a continuación involucra dos o más tipos de cáncer, se debe confirmar al menos uno de los tipos histológicos de cáncer. Los casos de cáncer gástrico de tipo intestinal y de cáncer de mama no lobulillar no se deben usar para cumplir con los criterios de las pruebas genéticas del HDGC (incluso si se valida el tipo histológico de estos tumores), porque estos cánceres no se relacionan con el HDGC. Para obtener más información, consultar la sección Evaluación genética en personas con antecedentes personales o familiares de cáncer gástrico en Genética del cáncer gástrico.
Cuando una persona cumple con los criterios para las pruebas genéticas del HDGC, pero no se encuentra una variante patogénica en el gen CDH1, se recomienda obtener una prueba genética del gen CTNNA1.
Criterios para los antecedentes personales
- Diagnóstico de cáncer gástrico difuso a los 49 años o menos.
- Diagnóstico de cáncer gástrico difuso a cualquier edad en personas de ascendencia maorí.
- Diagnóstico de cáncer gástrico difuso y presencia de labio o paladar hendidos en la misma persona.
- Diagnóstico de cáncer gástrico difuso y presencia de labio o paladar hendido en un familiar de primer grado (FPG).
- Diagnóstico de cáncer gástrico difuso y cáncer de mama lobulillar en la misma persona a los 69 años o menos.
- Diagnóstico de cáncer de mama lobulillar bilateral a los 69 años o menos.
- Diagnóstico de carcinoma gástrico de células en anillo de sello in situ o de diseminación pagetoide por el estómago de las células en anillo de sello a los 49 años o menos.
Criterios para la historia familiara
- Presencia de 2 o más casos de cáncer gástrico (por lo menos 1 caso de cáncer gástrico difuso) en la misma familia, sin importar la edad de presentación.
- Presencia de 1 o más casos de cáncer gástrico difuso diagnosticado a cualquier edad, y 1 o más casos de cáncer de mama lobulillar diagnosticado a los 69 años o menos (estos casos se deben presentar en familiares diferentes).
- Presencia de 2 o más casos de cáncer de mama lobulillar diagnosticado en familiares a los 49 años o menos.
aLos casos de cáncer se deben presentar en FPG o familiares de segundo grado entre sí. El IGCLC recomienda que los familiares afectados se sometan a pruebas genéticas cuando sea posible. Es posible que los proveedores consideren analizar el tejido (tumoral o sano) de familiares fallecidos afectados si no hay familiares vivos con cáncer de mama o cáncer gástrico. Si ninguna de estas opciones es factible, los proveedores pueden considerar las pruebas genéticas en familiares no afectados. Por lo general, el cáncer gástrico difuso se diagnostica en un estadio avanzado (es decir, estadio III o estadio IV).
References
- Blair VR, McLeod M, Carneiro F, et al.: Hereditary diffuse gastric cancer: updated clinical practice guidelines. Lancet Oncol 21 (8): e386-e397, 2020.
Familias con casos de cáncer similar al cáncer gástrico difuso hereditario: definición y abordaje
En el 30 % al 40 % de familias, de origen étnicos diferentes, con casos de HDGC definidos mediante criterios clínicos se encuentran variantes patogénicas de la línea germinal en el gen CDH1 . El International Gastric Cancer Linkage Consortium de 2020 define a las familias con casos de cáncer similar al HDGC como aquellas donde no se encuentran variantes patogénicas en los genes CDH1 o CTNNA1, pero donde hay casos de cáncer en familiares de primer grado (FPG) y familiares de segundo grado que cumplen con los criterios para la historia familiar que se describen a continuación:
- Diagnóstico de 2 o más casos de cáncer gástrico en la familia, con independencia de la edad, y por lo menos 1 caso de cáncer gástrico difuso.
- Diagnóstico de 1 o más casos de cáncer gástrico difuso a cualquier edad, y 1 o más casos de cáncer de mama lobulillar antes de los 70 años en diferentes familiares.
En las familias con casos de cáncer similar al HDGC, se debe considerar la vigilancia endoscópica anual durante por lo menos 2 años después de recibir resultados negativos en las pruebas genéticas del gen CDH1 en las personas afectadas y sus FPG. La vigilancia comienza a los 40 años de edad, o 10 años antes de la edad de diagnóstico del caso de cáncer gástrico más temprano en la familia. Es posible comenzar la vigilancia del HDGC a los 18 años de edad, pero no antes. Los intervalos de vigilancia se pueden prolongar a discreción del endoscopista después de que la persona haya participado en exámenes de detección anual durante 2 años. La decisión de prolongar el intervalo entre los exámenes de detección se basa en los hallazgos endoscópicos previos y en la historia familiar. En las familias con casos de cáncer similar al HDGC no se recomienda la gastrectomía total preventiva cuando no se encuentran alteraciones endoscópicas porque el grado de riesgo de cáncer gástrico en estas personas es incierto.
References
- Lynch HT, Grady W, Suriano G, et al.: Gastric cancer: new genetic developments. J Surg Oncol 90 (3): 114-33; discussion 133, 2005.
- Suriano G, Oliveira C, Ferreira P, et al.: Identification of CDH1 germline missense mutations associated with functional inactivation of the E-cadherin protein in young gastric cancer probands. Hum Mol Genet 12 (5): 575-82, 2003.
- Blair VR, McLeod M, Carneiro F, et al.: Hereditary diffuse gastric cancer: updated clinical practice guidelines. Lancet Oncol 21 (8): e386-e397, 2020.
Características genéticas
El cáncer gástrico difuso hereditario (HDGC) se identificó por primera vez en una familia extensa de origen indígena maorí en Nueva Zelanda. En estas personas se encontró una variante patogénicagerminal en el genCDH1. Desde este informe inicial, en muchos estudios se ha confirmado que el HDGC es un trastorno autosómico dominante poco frecuente que aumenta el riesgo de cáncer gástrico difuso y cáncer de mama lobulillar.
Aspectos de la biología molecular
En 1995, se localizó el gen CDH1 (cadherina 1) en el cromosoma 16q22.1. El gen CDH1 abarca una región de alrededor de 100 kb, tiene 16 exones y un intrón 2 de 65 kb de largo. Los límites entre los intrones y los exones están muy conservados. El intrón 1 contiene una isla de CPG de alta densidad en el extremo 5′ que quizás está implicada en la regulación transcripcional durante la embriogénesis y la formación del cáncer. El gen CDH1 codifica la glicoproteína transmembranaria cadherina E, que se expresa en el tejido epitelial y es responsable de la adhesión intercelular dependiente del calcio. La cadherina E es la primera molécula de adhesión que se expresa en el estadio de 8 células durante el desarrollo embrionario. Esta proteína es esencial para la compactación de la mórula y la posterior organización de los tejidos epiteliales. La proteína cadherina E es crucial para el establecimiento y mantenimiento de la arquitectura tisular y la homeostasis. La cadherina E forma, de manera primaria, uniones adherentes a través de enlaces homofílicos al dominio extracelular de las cadherinas que las células vecinas presentan. Estas estructuras de adhesión actúan como supresores tumorales, lo que previene la invasión tumoral y la metástasis. El dominio citoplasmático de la cadherina E se conecta al citoesqueleto de actina a través de diferentes cateninas (cateninas α, β y p120), lo que proporciona estructura a la célula y, al mismo tiempo, media la señalización celular. La cadherina E regula procesos celulares básicos como la proliferación, migración, apoptosis e invasión celular. La cadherina E es crucial para mantener la homeostasis tisular y, en efecto, la pérdida de cadherina E produce efectos patogénicos en las células. En 1998, se determinó que las variantes de la línea germinal de pérdida de función en el gen supresor de tumores CDH1 pueden causar HDGC.
Correlaciones entre genotipo y fenotipo
Las variantes patogénicas en CDH1 exhiben una heterogeneidad considerable en cuanto a los tipos de cáncer y la edad de aparición de esta enfermedad en los portadores. Sin embargo, en una revisión de la literatura médica disponible sobre CDH1 entre 1985 y 2018, no se encontraron correlaciones definitivas entre genotipo y fenotipo que pudieran orientar el abordaje del paciente. En esta revisión se encontró que las variantes patogénicas en el gen CDH1 se distribuyen de manera uniforme por todo el gen y no se identificó predominancia de un tipo de variante (es decir, terminadoras, sin sentido o de cambio de sentido, etc.) ni de su ubicación. En una investigación de 152 familias con HDGC se analizaron las asociaciones entre el estado de las variantes patogénicas de la línea germinal en el gen CDH1 de cada persona y el fenotipo clínico de HDGC que expresaba. En este estudio se encontró que las variantes en la región intracelular de la cadherina E del gen CDH1 protegen contra el cáncer a edades tempranas (oportunidad relativa [OR], 0,2; P = 0,0071). De manera similar, las variantes en las regiones conectoras del gen CDH1 protegen contra el cáncer de mama (OR, 0,35; P = 0,0493). En otro estudio se analizó la frecuencia de diferentes subtipos de variantes patogénicas en el gen CDH1 en personas asintomáticas (n = 289) y en personas con diagnóstico de cáncer gástrico (n = 224) pertenecientes a familias afectadas por HDGC. Entre portadores de variantes de CDH1, se encontraron variantes de empalme en el 30,4 % de las personas sanas y en el 15,2 % de los pacientes con cáncer gástrico (P = 0,0076). Las variantes de sentido erróneo se encontraron con más frecuencia en personas sanas (22,2 %) que en personas con cáncer gástrico (18,3 %), pero esta diferencia no alcanzó significación estadística. Los autores de este estudio concluyeron que no todas las variantes patogénicas de la línea germinal en el gen CDH1 confirieron el mismo riesgo de cáncer gástrico.
Se han observado posibles correlaciones entre genotipo y fenotipo en el gen CDH1 en familias con HDGC y labio leporino o paladar hendido. Sin embargo, no está claro cuales variantes patogénicas en el gen CDH1 producen labio leporino o paladar hendido. En 2006, se encontraron variantes en el sitio de empalme del gen CDH1 en dos familias con HDGC y labio leporino o paladar hendido. Las variantes en el sitio de empalme produjeron un empalme complejo y aberrante en los linfocitos. Sin embargo, después se identificaron variantes en el sitio de empalme del gen CDH1 en familias con HDGC no afectadas por labio leporino ni paladar hendido. En un artículo de revisión se observó que las familias con un fenotipo combinado de HDGC y labio leporino o paladar hendido tenían variantes de CDH1 que afectaban los dominios extracelulares. Sin embargo, también se han observado variantes en el gen CDH1 que afectan los dominios extracelulares en familias con HDGC aislado. En una revisión sistemática de 280 variantes patogénicas en el gen CDH1, se observó que las variantes encontradas en personas con labio leporino o paladar hendido se agrupaban muy juntas en regiones similares en el gen CDH1. Estas variantes a menudo residían dentro de regiones conectoras entre dominios extracelulares. Las diferencias entre las variantes patogénicas en personas con HDGC y labio leporino o paladar hendido versus aquellas que no tenían labio leporino ni paladar hendido no fueron lo suficientemente sólidas como para predecir de manera confiable el fenotipo de una variante específica en el gen CDH1. Sin embargo, estas diferencias pueden ayudar a los proveedores a evaluar con mayor exactitud el riesgo de labio leporino o paladar hendido en personas con variantes específicas en el gen CDH1.
El International Gastric Cancer Linkage Consortium creó el término cáncer de mama lobulillar hereditario para describir a las personas con una variante patogénica en el gen CDH1 y antecedentes personales o familiares de cáncer de mama lobulillar, pero sin antecedentes personales o familiares conocidos de cáncer gástrico. Dada la falta de datos que respalden una distinción genotípica o fenotípica entre el cáncer de mama lobulillar hereditario y el HDGC, en un estudio se evaluó la prevalencia del cáncer gástrico oculto en pacientes con cáncer de mama lobulillar hereditario y una variante patogénica en el gen CDH1. Los resultados indicaron que las variantes patogénicas germinales en CDH1 no exhiben una relación mutuamente excluyente con el cáncer de mama lobulillar hereditario ni con los fenotipos de HDGC. Además, las tasas de cáncer gástrico oculto fueron las mismas para personas con cáncer de mama lobulillar hereditario que para quienes tenían HDGC. Los autores hicieron hincapié en que las personas con cáncer de mama lobulillar hereditario deben someterse a vigilancia del cáncer gástrico y recibir asesoramiento sobre la gastrectomía preventiva.
En general, no hay datos suficientes sobre las posibles correlaciones entre genotipo y fenotipo del gen CDH1. Estos hallazgos no son lo suficientemente importantes como para guiar la evaluación del riesgo ni el control personalizado de este en función de las alteraciones en el gen CDH1.
References
- Guilford P, Hopkins J, Harraway J, et al.: E-cadherin germline mutations in familial gastric cancer. Nature 392 (6674): 402-5, 1998.
- Hansford S, Kaurah P, Li-Chang H, et al.: Hereditary Diffuse Gastric Cancer Syndrome: CDH1 Mutations and Beyond. JAMA Oncol 1 (1): 23-32, 2015.
- Brooks-Wilson AR, Kaurah P, Suriano G, et al.: Germline E-cadherin mutations in hereditary diffuse gastric cancer: assessment of 42 new families and review of genetic screening criteria. J Med Genet 41 (7): 508-17, 2004.
- Kaurah P, MacMillan A, Boyd N, et al.: Founder and recurrent CDH1 mutations in families with hereditary diffuse gastric cancer. JAMA 297 (21): 2360-72, 2007.
- Berx G, Staes K, van Hengel J, et al.: Cloning and characterization of the human invasion suppressor gene E-cadherin (CDH1). Genomics 26 (2): 281-9, 1995.
- Yelskaya Z, Bacares R, Salo-Mullen E, et al.: CDH1 Missense Variant c.1679C>G (p.T560R) Completely Disrupts Normal Splicing through Creation of a Novel 5' Splice Site. PLoS One 11 (11): e0165654, 2016.
- Paredes J, Figueiredo J, Albergaria A, et al.: Epithelial E- and P-cadherins: role and clinical significance in cancer. Biochim Biophys Acta 1826 (2): 297-311, 2012.
- van Roy F, Berx G: The cell-cell adhesion molecule E-cadherin. Cell Mol Life Sci 65 (23): 3756-88, 2008.
- Shapiro L, Fannon AM, Kwong PD, et al.: Structural basis of cell-cell adhesion by cadherins. Nature 374 (6520): 327-37, 1995.
- Aberle H, Schwartz H, Kemler R: Cadherin-catenin complex: protein interactions and their implications for cadherin function. J Cell Biochem 61 (4): 514-23, 1996.
- Okamoto R, Irie K, Yamada A, et al.: Recruitment of E-cadherin associated with alpha- and beta-catenins and p120ctn to the nectin-based cell-cell adhesion sites by the action of 12-O-tetradecanoylphorbol-13-acetate in MDCK cells. Genes Cells 10 (5): 435-45, 2005.
- Kim NG, Koh E, Chen X, et al.: E-cadherin mediates contact inhibition of proliferation through Hippo signaling-pathway components. Proc Natl Acad Sci U S A 108 (29): 11930-5, 2011.
- Figueiredo J, Melo S, Carneiro P, et al.: Clinical spectrum and pleiotropic nature of CDH1 germline mutations. J Med Genet 56 (4): 199-208, 2019.
- Lo W, Zhu B, Sabesan A, et al.: Associations of CDH1 germline variant location and cancer phenotype in families with hereditary diffuse gastric cancer (HDGC). J Med Genet 56 (6): 370-379, 2019.
- Corso G, Magnoni F, Massari G, et al.: CDH1 germline mutations in healthy individuals from families with the hereditary diffuse gastric cancer syndrome. J Med Genet 59 (4): 313-317, 2022.
- Frebourg T, Oliveira C, Hochain P, et al.: Cleft lip/palate and CDH1/E-cadherin mutations in families with hereditary diffuse gastric cancer. J Med Genet 43 (2): 138-42, 2006.
- Corso G, Marrelli D, Pascale V, et al.: Frequency of CDH1 germline mutations in gastric carcinoma coming from high- and low-risk areas: metanalysis and systematic review of the literature. BMC Cancer 12: 8, 2012.
- Obermair F, Rammer M, Burghofer J, et al.: Cleft lip/palate and hereditary diffuse gastric cancer: report of a family harboring a CDH1 c.687 + 1G > A germline mutation and review of the literature. Fam Cancer 18 (2): 253-260, 2019.
- Selvanathan A, Nixon CY, Zhu Y, et al.: CDH1 Mutation Distribution and Type Suggests Genetic Differences between the Etiology of Orofacial Clefting and Gastric Cancer. Genes (Basel) 11 (4): , 2020.
- Blair VR, McLeod M, Carneiro F, et al.: Hereditary diffuse gastric cancer: updated clinical practice guidelines. Lancet Oncol 21 (8): e386-e397, 2020.
- Gamble LA, Rossi A, Fasaye GA, et al.: Association Between Hereditary Lobular Breast Cancer Due to CDH1 Variants and Gastric Cancer Risk. JAMA Surg 157 (1): 18-22, 2022.
Manifestaciones clínicas
Riesgo de cáncer gástrico
En portadores de variantes patogénicas en el gen CDH1, el riesgo de por vida de cáncer gástrico difuso (hasta los 80 años) oscila entre el 37 % y el 70 % en hombres y entre el 25 % y el 83 % en mujeres. La edad promedio de aparición del cáncer gástrico oscila entre 38 y 80 años; el caso más temprano notificado ocurrió a los 14 años. Es importante reconocer que el cáncer gástrico difuso en portadores de variantes patogénicas en el gen CDH1 a menudo comienza como depósitos microscópicos multifocales de carcinoma de células de anillo de sello. El cáncer gástrico difuso hereditario (HDGC) surge en la región del cuello (istmo) de las glándulas gástricas (en lugar del epitelio superficial), donde tiende a formarse displasia por factores de riesgo ambientales e inflamatorios. Estos carcinomas de células en anillo de sello crecen de manera difusa, pero sutil, en la mucosa y submucosa adyacentes. El cáncer gástrico difuso relacionado con el gen CDH1 tiene una presentación y curso clínicos similares a los del cáncer gástrico difuso esporádico. El tratamiento mínimamente invasivo es una opción cuando se encuentran lesiones precursoras con la endoscopia. Sin embargo, la mayoría de las lesiones de células en anillo de sello en crecimiento propias del HDGC no se detectan hasta que alcanzan un estadio avanzado. El HDGC comienza como células en anillo de sello multifocales por todo el estómago, pero no está claro si esto también ocurre en el cáncer gástrico difuso esporádico.
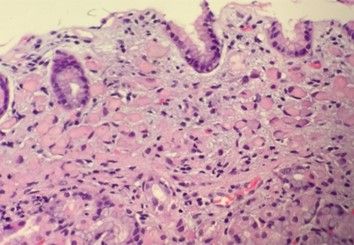 Figura 1. Fotografía tomada con un microscopio de gran resolución de una muestra de tejido gástrico obtenida mediante biopsia donde se observa un carcinoma de células en anillo de sello. No hay formaciones glandulares, lo que indica que la lesión es un carcinoma pobremente diferenciado. También se muestra que el epitelio suprayacente, aunque borrado por la presencia del tumor subyacente, es por lo demás normal.
Figura 1. Fotografía tomada con un microscopio de gran resolución de una muestra de tejido gástrico obtenida mediante biopsia donde se observa un carcinoma de células en anillo de sello. No hay formaciones glandulares, lo que indica que la lesión es un carcinoma pobremente diferenciado. También se muestra que el epitelio suprayacente, aunque borrado por la presencia del tumor subyacente, es por lo demás normal.
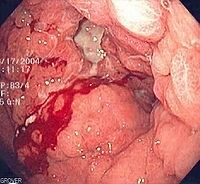 Figura 2. Fotografía endoscópica de un cáncer gástrico difuso con compromiso típico de linitis plástica, que se produce en un estadio avanzado. Se observa una infiltración difusa en la mucosa y la submucosa gástricas de manera que todo el estómago se vuelve rígido, perdiendo contractibilidad y capacidad para digerir los alimentos, lo que a su vez produce los síntomas típicos de náuseas y vómitos. La biopsia suele ser informativa, pero en ocasiones una biopsia muy superficial produce un resultado negativo. Por lo tanto, es imprescindible que un especialista en patología busque células en anillo de sello aisladas en las muestras tomadas por biopsia.
Figura 2. Fotografía endoscópica de un cáncer gástrico difuso con compromiso típico de linitis plástica, que se produce en un estadio avanzado. Se observa una infiltración difusa en la mucosa y la submucosa gástricas de manera que todo el estómago se vuelve rígido, perdiendo contractibilidad y capacidad para digerir los alimentos, lo que a su vez produce los síntomas típicos de náuseas y vómitos. La biopsia suele ser informativa, pero en ocasiones una biopsia muy superficial produce un resultado negativo. Por lo tanto, es imprescindible que un especialista en patología busque células en anillo de sello aisladas en las muestras tomadas por biopsia.
Riesgo de cáncer de mama
En la población general, la mayoría de los casos de cáncer de mama corresponden a tipos ductales, mientras que cerca del 10 % son lobulillares. Por el contrario, la mayoría de los casos de cáncer de mama en mujeres con variantes patogénicas germinales en el gen CDH1 son lobulillares. Se calcula que la penetrancia es del 39 % al 55 % para el cáncer de mama lobulillar invasivo (CLI) en mujeres con variantes patogénicas en el gen CDH1 hasta los 80 años de edad. En los estudios se observó que el riesgo de CLI aumenta antes de los 30 años de edad, con una edad promedio de inicio entre los 46 y 50 años. Las características histopatológicas e inmunohistoquímicas del CLI relacionado con alteraciones germinales en el gen CDH1 y del CLI esporádico son indistinguibles. En general, el CLI tiende a ser multicéntrico y no se forman masas bien definidas. En cambio, los CLI se componen de células epiteliales pequeñas infiltrantes, dispersas una por una en un patrón lineal dentro de estroma fibroso. Estas células no expresan la molécula de adhesión intercelular cadherina E. El CLI casi siempre se encuentra en estadio avanzado y en el 10 % al 15 % de los casos es bilateral. Las características del CLI suelen asociarse con un buen pronóstico porque, por lo general, son de grado bajo, exhiben positividad para el receptor de estrógeno (ER) y negatividad para el receptor 2 del factor de crecimiento epidérmico humano (HER2). Sin embargo, el CLI tiene un riesgo más alto de recidiva a distancia después de 10 años en comparación con el cáncer de mama ductal. El CLI también suele metastatizar en sitios inusuales, como el tubo digestivo y las meninges. Las directrices para el tratamiento del CLI en portadores de alteraciones en el gen CDH1 no difieren de las directrices de tratamiento para casos de CLI esporádico.
References
- Pharoah PD, Guilford P, Caldas C, et al.: Incidence of gastric cancer and breast cancer in CDH1 (E-cadherin) mutation carriers from hereditary diffuse gastric cancer families. Gastroenterology 121 (6): 1348-53, 2001.
- Roberts ME, Ranola JMO, Marshall ML, et al.: Comparison of CDH1 Penetrance Estimates in Clinically Ascertained Families vs Families Ascertained for Multiple Gastric Cancers. JAMA Oncol 5 (9): 1325-1331, 2019.
- Xicola RM, Li S, Rodriguez N, et al.: Clinical features and cancer risk in families with pathogenic CDH1 variants irrespective of clinical criteria. J Med Genet 56 (12): 838-843, 2019.
- Hansford S, Kaurah P, Li-Chang H, et al.: Hereditary Diffuse Gastric Cancer Syndrome: CDH1 Mutations and Beyond. JAMA Oncol 1 (1): 23-32, 2015.
- Delgado E, León-Ponte M, Villahermosa ML, et al.: Analysis of HIV type 1 protease and reverse transcriptase sequences from Venezuela for drug resistance-associated mutations and subtype classification: a UNAIDS study. AIDS Res Hum Retroviruses 17 (8): 753-8, 2001.
- Caldas C, Carneiro F, Lynch HT, et al.: Familial gastric cancer: overview and guidelines for management. J Med Genet 36 (12): 873-80, 1999.
- Li CI, Anderson BO, Daling JR, et al.: Trends in incidence rates of invasive lobular and ductal breast carcinoma. JAMA 289 (11): 1421-4, 2003.
- Corso G, Intra M, Trentin C, et al.: CDH1 germline mutations and hereditary lobular breast cancer. Fam Cancer 15 (2): 215-9, 2016.
- Corso G, Figueiredo J, La Vecchia C, et al.: Hereditary lobular breast cancer with an emphasis on E-cadherin genetic defect. J Med Genet 55 (7): 431-441, 2018.
- Masciari S, Larsson N, Senz J, et al.: Germline E-cadherin mutations in familial lobular breast cancer. J Med Genet 44 (11): 726-31, 2007.
- Kaurah P, MacMillan A, Boyd N, et al.: Founder and recurrent CDH1 mutations in families with hereditary diffuse gastric cancer. JAMA 297 (21): 2360-72, 2007.
- Mouabbi JA, Hassan A, Lim B, et al.: Invasive lobular carcinoma: an understudied emergent subtype of breast cancer. Breast Cancer Res Treat 193 (2): 253-264, 2022.
- Pilonis ND, Tischkowitz M, Fitzgerald RC, et al.: Hereditary Diffuse Gastric Cancer: Approaches to Screening, Surveillance, and Treatment. Annu Rev Med 72: 263-280, 2021.
- Rakha EA, El-Sayed ME, Powe DG, et al.: Invasive lobular carcinoma of the breast: response to hormonal therapy and outcomes. Eur J Cancer 44 (1): 73-83, 2008.
- Lamovec J, Bracko M: Metastatic pattern of infiltrating lobular carcinoma of the breast: an autopsy study. J Surg Oncol 48 (1): 28-33, 1991.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Breast Cancer. Version 4.2023. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2023. Available online with free registration. Last accessed May 31, 2023.
Atención médica
Intervención quirúrgica: Gastrectomía preventiva
La gastrectomía total con esofagoyeyunostomía preventiva (profiláctica o para reducir el riesgo) continúan siendo el tratamiento de elección para las personas con variantes patogénicas en el gen CDH1. Las personas afectadas menores de 18 años o mayores 70 años necesitan un abordaje más personalizado debido a la tasa alta de morbilidad quirúrgica. La gastrectomía se puede hacer con abordaje robótico, laparoscópico o abierto (tradicional). Siempre se debe tener cuidado y asegurarse de que los márgenes quirúrgicos estén libres de epitelio gástrico.
Los desenlaces funcionales después de la gastrectomía total preventiva varían, pero la pérdida de peso es universal. En una serie se notificó entre el 15 % y el 20 % de pérdida de peso promedio después de la cirugía. La mayoría de los pacientes finalmente se adaptan a este cambio después de la cirugía, pero su estado nutricional se debe vigilar de cerca. Otros riesgos de la gastrectomía son deficiencias nutricionales, fugas anastomóticas, infecciones intraabdominales, síntomas digestivos como diarrea y reflujo, y una tasa de mortalidad que oscila entre el 3 % y el 6 %.
Vigilancia endoscópica
La gastrectomía total preventiva es el tratamiento de elección para los pacientes con cáncer gástrico difuso hereditario (HDGC) porque es la única manera de minimizar el riesgo de cáncer gástrico, dada la falta de lesiones precursoras identificables de manera sistemática en la endoscopia. Cuando se lleva a cabo una gastrectomía, por lo general se encuentran múltiples focos microscópicos de carcinoma de células en anillo de sello. Por el contrario, el muestreo al azar o dirigido del estómago durante la endoscopia a menudo no permite identificar los focos microscópicos del carcinoma de células de anillo de sello. Dado que el cáncer gástrico difuso suele conllevar un pronóstico sombrío y por lo general se encuentra en un estadio avanzado, la mayoría de los expertos recomiendan la gastrectomía total, con independencia del número de lesiones de células en anillo de sello que se encuentran durante el muestreo endoscópico. En una serie, 6 pacientes, de la misma familia, con variantes patogénicas en el gen CDH1 (media de edad, 54 años) se sometieron a gastrectomía total preventiva a pesar de la ausencia de síntomas y de contar con antecedentes de esofagogastroduodenoscopias (EGE) normales con biopsias aleatorias del estómago negativas para compromiso neoplásico. Se observaron focos microscópicos de carcinoma de células en anillo de sello en todas las personas sometidas a gastrectomía total preventiva.
De manera más reciente, se llevó a cabo una investigación de vigilancia mediante EGE en 20 portadores de alteraciones en el gen CDH1. No se encontraron lesiones sospechosas en ningún participante durante los exámenes de EGE. Sin embargo, se encontró carcinoma de células de anillo de sello en el 40 % de las muestras de biopsia endoscópica de los pacientes. En cada participante se obtuvieron 30 o más muestras durante las biopsias endoscópicas aleatorias.
La vigilancia endoscópica del HDGC tiene una función, en especial, en los pacientes que deciden diferir la gastrectomía total preventiva. Otros escenarios que pueden impulsar la vigilancia endoscópica son los siguientes:
- Pacientes con historia familiar indicativa de HDGC, pero en quienes no se ha identificado ninguna variante patogénica.
- Pacientes con historia familiar de cáncer gástrico de tipo intestinal. Por lo general, este tipo de cáncer gástrico no se relaciona con variantes patogénicas en el gen CDH1. Por lo tanto, es necesario personalizar la vigilancia endoscópica para estos pacientes.
- Pacientes que tienen una variante patogénica en el gen CDH1 y deciden diferir la gastrectomía total preventiva durante un año o más. Esto incluye a los aquellos que se someten a pruebas genéticas a una edad temprana y que dan positivo para una variante patogénica en el gen CDH1. Por lo general, no se recomienda la gastrectomía preventiva en personas menores de 18 a 20 años. A pesar de que se les advierta sobre la tasa precaria de detección de las lesiones precursoras del HDGC en la biopsia endoscópica, muchos pacientes (en especial, aquellos de edad avanzada) solo considerarán la gastrectomía en caso de una biopsia positiva para compromiso neoplásico.
No hay características definitivas e identificables del cáncer gástrico difuso temprano ni lesiones precursoras de este cáncer que se puedan encontrar en la endoscopia. Por lo tanto, se toma un número importante de biopsias aleatorias de la mucosa gástrica durante la endoscopia, ya que el epitelio que cubre el carcinoma de células de anillo de sello por lo general tiene apariencia normal. En los primeros informes se indicó que las personas con HDGC pueden tener muchos tumores microscópicos en la zona de transición entre el cuerpo y el antro del estómago. Sin embargo, en un estudio más reciente se indicó que estos tumores suelen comprometer la mucosa oxíntica y el estómago proximal.
En varios estudios se indicó que la presencia de placas pequeñas y blancas en el estómago pueden indicar que hay un foco de carcinoma de células en anillo de sello subyacente. La biopsia de estas lesiones blancas puede mejorar el rendimiento de la endoscopia.
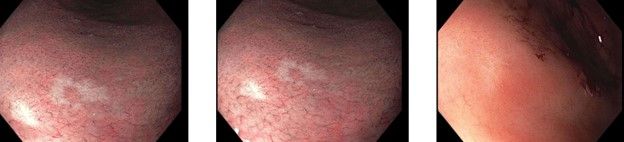 Figura 3. En las imágenes de banda estrecha se observan mejor múltiples áreas pequeñas, blancas y ligeramente deprimidas. Estas lesiones parecen cicatrices de biopsias endoscópicas previas; sin embargo, las fotografías que se muestran corresponden a un paciente que no se había sometido antes a una esofagogastroduodenoendoscopia. En la biopsia que se obtuvo se encontró un foco microscópico de carcinoma de células en anillo de sello. En este mismo paciente, otras biopsias no dirigidas, también fueron positivas para el carcinoma de células en anillo de sello.
Figura 3. En las imágenes de banda estrecha se observan mejor múltiples áreas pequeñas, blancas y ligeramente deprimidas. Estas lesiones parecen cicatrices de biopsias endoscópicas previas; sin embargo, las fotografías que se muestran corresponden a un paciente que no se había sometido antes a una esofagogastroduodenoendoscopia. En la biopsia que se obtuvo se encontró un foco microscópico de carcinoma de células en anillo de sello. En este mismo paciente, otras biopsias no dirigidas, también fueron positivas para el carcinoma de células en anillo de sello.
En otro estudio se informó sobre 33 pacientes con variantes patogénicas del gen CDH1 (mediana de edad, 32 años) que eran miembros de la familia original maorí en la que se descubrió por primera vez el HDGC. Los participantes se sometieron a 99 endoscopias de vigilancia, 93 de las cuales se realizaron con N-acetilcisteína como mucolítico seguido de tinción con los colorantes azul de metileno y rojo Congo. En 24 de las 93 endoscopias se observaron lesiones planas y blanquecinas de entre 2 mm y 10 mm de diámetro. En 23 de las 56 lesiones que se biopsiaron (41 %) se encontró carcinoma de células en anillo de sello. Los autores concluyeron que estas lesiones se podían delimitar mejor con los colorantes cromógenos azul de metileno y rojo Congo. Los rendimientos de las biopsias aumentaron cuando se usaron estos colorantes. Sin embargo, los autores expresaron preocupación por el hecho de que el colorante rojo Congo tenga propiedades cancerígenas y ha caído en desuso.
Si se opta por un abordaje endoscópico para la vigilancia del HDGC, se recomienda endoscopia anual, a menos que se encuentren características indicadoras de células en anillo de sello. Si se encuentran lesiones de células en anillo de sello en la endoscopia, se justifica el análisis por un equipo multidisciplinario. Sin embargo, el riesgo de cáncer gástrico difuso sigue sin estar claro en las personas en quienes se encuentran focos de células en anillo de sello en la endoscopia.
Control del riesgo de cáncer de mama
Las modalidades de detección sistemática del cáncer de mama en las mujeres con una variante patogénica en el gen CDH1 son las siguientes:
Imágenes por resonancia magnética de la mama:
- La National Comprehensive Cancer Network (NCCN) recomienda considerar imágenes por resonancia magnética (IRM) contrastada de la mama a partir de los 30 años de edad.
- El International Gastric Cancer Linkage Consortium (IGCLC) recomienda IRM de la mama anual desde los 30 años, ya que la mamografía no es eficaz para identificar el cáncer de mama lobulillar.
Mamografía:
- El NCCN y el IGCLC tienen recomendaciones diferentes con respecto a la edad para comenzar la detección con mamografía.
- El NCCN recomienda una mamografía de detección anual a partir de los 30 años de edad.
- El IGCLC recomienda que la mamografía de detección anual comience entre los 35 y los 40 años de edad, según los factores de riesgo para el cáncer de mama, como la densidad mamaria.
Otras imágenes:
- El IGCLC indica que se puede considerar la detección complementaria de las mamas densas con ecografía, en especial cuando la IRM no está disponible, está contraindicada o la paciente se rehúsa a hacerla.
Es posible considerar la mastectomía bilateral preventiva en mujeres con una variante patogénica en el gen CDH1 según la historia familiar de cáncer de mama, otros factores de riesgo de este cáncer o por decisión personal.
References
- Blair VR, McLeod M, Carneiro F, et al.: Hereditary diffuse gastric cancer: updated clinical practice guidelines. Lancet Oncol 21 (8): e386-e397, 2020.
- Vos EL, Salo-Mullen EE, Tang LH, et al.: Indications for Total Gastrectomy in CDH1 Mutation Carriers and Outcomes of Risk-Reducing Minimally Invasive and Open Gastrectomies. JAMA Surg 155 (11): 1050-1057, 2020.
- Strong VE, Gholami S, Shah MA, et al.: Total Gastrectomy for Hereditary Diffuse Gastric Cancer at a Single Center: Postsurgical Outcomes in 41 Patients. Ann Surg 266 (6): 1006-1012, 2017.
- Norton JA, Ham CM, Van Dam J, et al.: CDH1 truncating mutations in the E-cadherin gene: an indication for total gastrectomy to treat hereditary diffuse gastric cancer. Ann Surg 245 (6): 873-9, 2007.
- Jacobs MF, Dust H, Koeppe E, et al.: Outcomes of Endoscopic Surveillance in Individuals With Genetic Predisposition to Hereditary Diffuse Gastric Cancer. Gastroenterology 157 (1): 87-96, 2019.
- Charlton A, Blair V, Shaw D, et al.: Hereditary diffuse gastric cancer: predominance of multiple foci of signet ring cell carcinoma in distal stomach and transitional zone. Gut 53 (6): 814-20, 2004.
- Fujita H, Lennerz JK, Chung DC, et al.: Endoscopic surveillance of patients with hereditary diffuse gastric cancer: biopsy recommendations after topographic distribution of cancer foci in a series of 10 CDH1-mutated gastrectomies. Am J Surg Pathol 36 (11): 1709-17, 2012.
- Shaw D, Blair V, Framp A, et al.: Chromoendoscopic surveillance in hereditary diffuse gastric cancer: an alternative to prophylactic gastrectomy? Gut 54 (4): 461-8, 2005.
- National Comprehensive Cancer Network: NCCN Clinical Practice Guidelines in Oncology: Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic. Version 2.2024. Plymouth Meeting, Pa: National Comprehensive Cancer Network, 2023. Available online with free registration. Last accessed October 31, 2023.
- Pereslucha AM, Wenger DM, Morris MF, et al.: Invasive Lobular Carcinoma: A Review of Imaging Modalities with Special Focus on Pathology Concordance. Healthcare (Basel) 11 (5): , 2023.
Actualizaciones más recientes a este resumen (12/04/2023)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Este resumen es nuevo.
El Consejo editorial del PDQ sobre la genética del cáncer es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre la genética del cáncer gástrico difuso hereditario. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El Consejo editorial del PDQ sobre la genética del cáncer, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Cáncer gástrico difuso hereditario son:
- Doreen Agnese, MD (The Ohio State University)
- Ilana Cass, MD (Dartmouth-Hitchcock Medical Center)
- Lee-may Chen, MD (UCSF Helen Diller Family Comprehensive Cancer Center)
- Mary B. Daly, MD, PhD (Fox Chase Cancer Center)
- Grace-Ann O. Fasaye, ScM, CGC (National Cancer Institute)
- Gautam Mankaney, MD (Virginia Mason Franciscan Health)
- Tuya Pal, MD, FACMG, FCCMG (Vanderbilt-Ingram Cancer Center)
- Padma Sheila Rajagopal, MD, MPH, MSC (National Cancer Institute)
- Mary Beth Terry, PhD (Columbia University Mailman School of Public Health)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El Consejo editorial del PDQ sobre la genética del cáncer emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre la genética del cáncer. PDQ Cáncer gástrico difuso hereditario. Bethesda, MD: National Cancer Institute. Actualización:
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
La información en estos resúmenes no se debe utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.