Instituto Nacional del Cáncer
encontrar mi
Fecha de publicación: Feb 22, 2024
Información sobre las complicaciones del trasplante hematopoyético (infusión de células madre para restaurar el sistema sanguíneo) en pediatría, la enfermedad de injerto contra huésped y los efectos tardíos. Resumen para profesionales de la salud.
Complicaciones del trasplante hematopoyético en pediatría
Comorbilidades anteriores al trasplante que afectan el riesgo de mortalidad relacionada con el trasplante: Poder predictivo del Hematopoietic Cell Transplantation-Specific Comorbidity Index
Debido a la intensidad de la terapia relacionada con el proceso de trasplante, el estado clínico del receptor antes del procedimiento (que abarca aspectos como la edad, la presencia de infecciones o disfunción orgánica, y el estado funcional) se vincula con el riesgo de mortalidad relacionada con el trasplante.
La mejor herramienta para evaluar la repercusión de comorbilidades anteriores al trasplante sobre los desenlaces posteriores se formuló mediante la adaptación de una escala de comorbilidad ya existente, el Charlson Comorbidity Index (CCI). Investigadores del Fred Hutchinson Cancer Research Center definieron en forma sistemática qué elementos del CCI se correlacionaban con la mortalidad relacionada con el trasplante en adultos y niños. También determinaron varias afecciones comórbidas que tienen una capacidad de predicción específica para pacientes que reciben trasplantes.
Gracias a una validación exitosa se logró definir un índice de comorbilidad específico para el trasplante de células hematopoyéticas que ahora se denomina Hematopoietic Cell Transplantation-Specific Comorbidity Index (HCT-CI). La tasa de mortalidad relacionada con el trasplante aumenta cuando hay comorbilidades cardíacas, hepáticas, pulmonares, gastrointestinales, infecciosas y autoinmunitarias, o antecedentes de tumores sólidos (consultar el Cuadro 1).
| Puntaje del HCT-CI | ||
|---|---|---|
| 1 | 2 | 3 |
| AST/ALT = aspartato–aminotransferasa/alanina–aminotransferasa; DLCO = capacidad de difusión pulmonar para el monóxido de carbono; VEF1 = volumen espiratorio forzado en un segundo; HCT-CI = Hematopoietic Cell Transplantation-Specific Comorbidity Index. | ||
| aAdaptado de Sorror et al. | ||
| bUna o más arterias coronarias con estenosis para las que se necesita tratamiento médico, endoprótesis o injerto de derivación. | ||
| Arritmia: fibrilación o aleteo auriculares, disfunción sinusal o arritmias ventriculares | Comorbilidad pulmonar moderada: DLCO o VEF1 del 66–80 %, o disnea en actividad leve | Valvulopatía cardíaca: excepto el prolapso de la válvula mitral |
| Comorbilidades cardíacas: coronariopatía,b insuficiencia cardíaca congestiva, infarto de miocardio o fracción de expulsión ≤50 % | Comorbilidades renales moderadas a graves: creatinina sérica >2 mg/dl, en diálisis o con trasplante renal previo | Comorbilidades hepáticas moderadas a graves: cirrosis hepática, bilirrubina >1,5 veces el límite superior normal o AST/ALT >2,5 veces el límite superior normal |
| Enfermedades cerebrovasculares: accidente isquémico transitorio o accidente cerebrovascular | Úlcera péptica: que necesita tratamiento | Tumor sólido previo: tratado en cualquier momento de la vida del paciente, excepto un cáncer de piel no melanoma |
| Diabetes: que necesita tratamiento con insulina o hipoglucémicos orales y no se puede tratar solo con un régimen alimentario | Comorbilidades reumatológicas: lupus eritematoso sistémico, artritis reumatoide, polimiositis, enfermedad mixta del tejido conjuntivo o polimialgia reumática | Comorbilidad pulmonar grave: DLCO o VEF1 <65 % o disnea en reposo, o para la que se necesita oxígeno |
| Comorbilidades hepáticas leves: hepatitis crónica, bilirrubina elevada o AST/ALT elevada o > 2,5 veces el límite superior normal | ||
| Infección: que necesita continuar con el tratamiento antimicrobiano después del día 0 | ||
| Enfermedad inflamatoria intestinal: enfermedad de Crohn o colitis ulcerosa | ||
| Obesidad: índice de masa corporal >35 kg/m2 | ||
| Alteración psiquiátrica: depresión o ansiedad para las que se necesita consulta o tratamiento psiquiátrico | ||
Este índice tiene gran poder predictivo para la mortalidad relacionada con el trasplante y la supervivencia general (SG); el cociente de riesgos instantáneos es de 3,54 (intervalo de confianza [IC] 95 %, 2,0–6,3) para la mortalidad sin recaída y de 2,69 (IC 95 %, 1,8–4,1) para la supervivencia de pacientes con puntaje de 3 o superior en comparación con aquellos con puntaje de 0. Aunque en los estudios originales participaron pacientes tratados con abordajes mielosupresores intensivos, se observó que el HCT-CI también predice los desenlaces de los pacientes tratados con regímenes no mielosupresores de intensidad reducida. El índice también se combinó con el estado de la enfermedad y el puntaje de Karnofsky, lo que condujo a un pronóstico incluso mejor de los resultados de supervivencia. Asimismo, los puntajes altos de HCT-CI (>3) se han relacionado con un riesgo más elevado de enfermedad de injerto contra huésped (enfermedad de injerto contra receptor) aguda de grados III a IV.
La mayoría de pacientes evaluados en los estudios de HCT-CI han sido adultos y las comorbilidades enumeradas están sesgadas por las enfermedades de los adultos. La importancia de esta escala para los receptores pediátricos y adultos jóvenes de trasplante de células madre hematopoyéticas (TCMH) se evaluó en varios estudios.
Evidencia (uso del puntaje HCT-CI en pediatría):
- Se condujo un estudio de cohortes retrospectivo en 4 centros grandes de pacientes pediátricos (mediana de edad, 6 años) con una variedad amplia de trastornos malignos y benignos.
- El HCT-CI fue un factor predictivo de la mortalidad no relacionada con las recaídas y la supervivencia.
- Las tasas de mortalidad no relacionada con las recaídas a 1 año fueron las siguientes:
- Del 10 % en pacientes con puntajes de 0.
- Del 14 % en pacientes con puntajes de 1 a 2.
- Del 28 % en pacientes con puntajes de 3 o superiores.
- Las tasas de SG a 1 año fueron las siguientes:
- Del 88 % en pacientes con puntajes de 0.
- Del 67 % en pacientes con puntajes de 1 a 2.
- Del 62 % en pacientes con puntajes de 3 o superiores.
- En un segundo estudio se incluyeron adultos jóvenes (edad, 16–39 años) y se demostró lo siguiente:
- Aumentos similares en la mortalidad con puntajes del HCT-CI superiores.
- Las tasas de mortalidad no relacionada con las recaídas fueron del 24 % en pacientes con puntajes de 0 a 2 y del 38 % en pacientes con puntajes de 3 o superiores.
- Las tasas de SG fueron del 46 % en pacientes con puntajes de 0 a 2 y del 28 % en pacientes con puntajes de 3 o superiores.
- Durante la validación prospectiva del HCT-CI realizada por el Center for International Blood and Marrow Transplant Research, se asignaron puntajes y se siguieron los desenlaces de 23 876 pacientes (entre ellos, 1755 niños) que recibieron trasplantes entre 2007 y 2009.
- Aunque aumentó la mortalidad en los adultos tratados con regímenes mielosupresores y que tenían puntajes de 1 a 2, en los pacientes pediátricos no hubo aumento de la mortalidad hasta que el HCT-CI indicó un puntaje de 3 o más.
La mayoría de las afecciones comórbidas notificadas fueron afecciones respiratorias o hepáticas, e infecciones. En el estudio de adolescentes y adultos jóvenes, los pacientes con disfunción pulmonar previa al TCMH tuvieron un riesgo especialmente alto de comorbilidad, con una tasa SG a 2 años del 29 % en comparación con el 61 % en los pacientes con funcionamiento pulmonar normal antes del TCMH.
References
- Sorror ML, Maris MB, Storb R, et al.: Hematopoietic cell transplantation (HCT)-specific comorbidity index: a new tool for risk assessment before allogeneic HCT. Blood 106 (8): 2912-9, 2005.
- ElSawy M, Storer BE, Pulsipher MA, et al.: Multi-centre validation of the prognostic value of the haematopoietic cell transplantation- specific comorbidity index among recipient of allogeneic haematopoietic cell transplantation. Br J Haematol 170 (4): 574-83, 2015.
- Sorror ML, Storer BE, Maloney DG, et al.: Outcomes after allogeneic hematopoietic cell transplantation with nonmyeloablative or myeloablative conditioning regimens for treatment of lymphoma and chronic lymphocytic leukemia. Blood 111 (1): 446-52, 2008.
- Sorror ML, Sandmaier BM, Storer BE, et al.: Comorbidity and disease status based risk stratification of outcomes among patients with acute myeloid leukemia or myelodysplasia receiving allogeneic hematopoietic cell transplantation. J Clin Oncol 25 (27): 4246-54, 2007.
- Sorror M, Storer B, Sandmaier BM, et al.: Hematopoietic cell transplantation-comorbidity index and Karnofsky performance status are independent predictors of morbidity and mortality after allogeneic nonmyeloablative hematopoietic cell transplantation. Cancer 112 (9): 1992-2001, 2008.
- Sorror ML, Martin PJ, Storb RF, et al.: Pretransplant comorbidities predict severity of acute graft-versus-host disease and subsequent mortality. Blood 124 (2): 287-95, 2014.
- Smith AR, Majhail NS, MacMillan ML, et al.: Hematopoietic cell transplantation comorbidity index predicts transplantation outcomes in pediatric patients. Blood 117 (9): 2728-34, 2011.
- Wood W, Deal A, Whitley J, et al.: Usefulness of the hematopoietic cell transplantation-specific comorbidity index (HCT-CI) in predicting outcomes for adolescents and young adults with hematologic malignancies undergoing allogeneic stem cell transplant. Pediatr Blood Cancer 57 (3): 499-505, 2011.
- Sorror ML, Logan BR, Zhu X, et al.: Prospective Validation of the Predictive Power of the Hematopoietic Cell Transplantation Comorbidity Index: A Center for International Blood and Marrow Transplant Research Study. Biol Blood Marrow Transplant 21 (8): 1479-87, 2015.
Complicaciones graves relacionadas con el trasplante de células madre hematopoyéticas
Riesgo de infecciones y recuperación inmunitaria después del trasplante
La reconstitución inmunitaria defectuosa es un obstáculo importante para un TCMH satisfactorio, con independencia de la fuente del injerto. Se observó que las infecciones graves dan cuenta de un porcentaje significativo (4–20 %) de muertes tardías después de un TCMH.
Los factores que puede demorar significativamente la recuperación inmunitaria son los siguientes:
- Manipulación del injerto (eliminación de células T).
- Fuente de células madre (recuperación lenta con sangre de cordón umbilical).
- Enfermedad de injerto contra huésped (EICH) crónica.
En la Figura 1 se muestran los defectos inmunitarios, los factores relacionados con el trasplante que afectan la recuperación inmunitaria, y los tipos y la cronología de las infecciones que se presentan después de un trasplante alogénico.
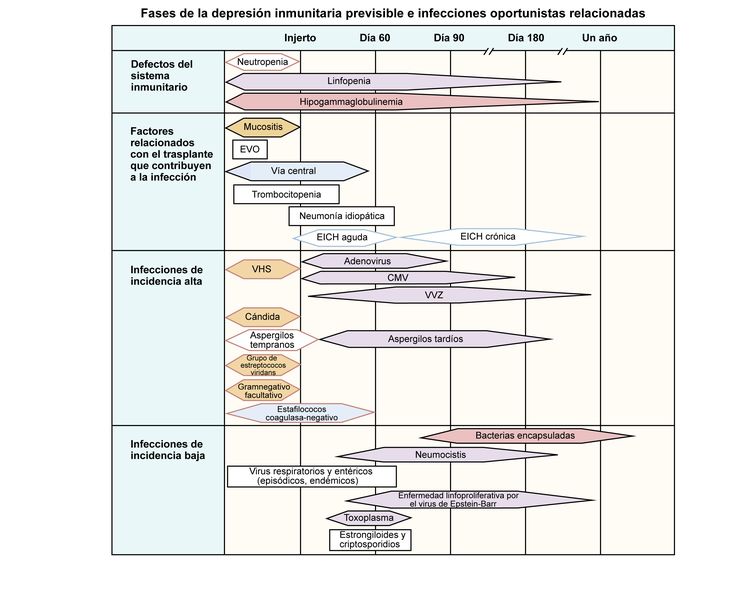 Figura 1. Fases previsibles de la depresión inmunitaria y las infecciones oportunistas relacionadas entre los receptores de trasplante de células madre hematopoyéticas alogénicas. Adaptado de Burik and Freifeld. Esta figura se publicó en Clinical Oncology, 3rd edition, Abeloff et al., Capítulo: Infection in the severely immunocompromised patient, Páginas 941–956, Derechos de autor Elsevier (2004).
Figura 1. Fases previsibles de la depresión inmunitaria y las infecciones oportunistas relacionadas entre los receptores de trasplante de células madre hematopoyéticas alogénicas. Adaptado de Burik and Freifeld. Esta figura se publicó en Clinical Oncology, 3rd edition, Abeloff et al., Capítulo: Infection in the severely immunocompromised patient, Páginas 941–956, Derechos de autor Elsevier (2004).
Las infecciones bacterianas tienden a presentarse en las primeras semanas después del trasplante durante la fase neutropénica, cuando las barreras mucosas se dañan con el régimen de acondicionamiento. Hay investigaciones importantes en curso sobre la función de los fármacos antibacterianos profilácticos durante la fase neutropénica.
En un esfuerzo conjunto, los centros para el Control y la Prevención de Enfermedades, la Infectious Disease Society of America y la American Society of Transplantation and Cellular Therapy establecieron directrices para la prevención de infecciones después del TCMH. Los abordajes incluyen antivirales, antifúngicos y antibióticos preventivos o profilácticos; el aumento gradual de la dosis para administrar terapia empírica intensa cuando aparecen signos de infección, y el seguimiento minucioso continuado durante todo el periodo de inmunodepresión después del trasplante.
La profilaxis contra infecciones fúngicas es estándar durante los primeros meses después del trasplante y en ocasiones se considera para los pacientes con EICH crónica que tienen un riesgo alto de presentar estas infecciones. La profilaxis antifúngica se debe adaptar al estado inmunitario subyacente del paciente. Las infecciones por Pneumocystis se pueden presentar en todos los pacientes después de un trasplante de médula ósea y la profilaxis es imprescindible.; [Nivel de evidencia C1]
Las infecciones víricas son una causa importante de mortalidad después de un TCMH, en particular después de procedimientos de reducción de células T o con sangre de cordón umbilical. Algunos tipos de infecciones víricas son los siguientes:
- Infección por citomegalovirus (CMV). La infección por CMV fue una causa importante de mortalidad en el pasado, pero en la actualidad, se cuenta con fármacos eficaces para su tratamiento. Además, se han elaborado estrategias preventivas, como la vigilancia mediante reacción en cadena de la polimerasa (PCR) cuantitativa seguida de terapia presintomática con ganciclovir.
- Infección por el virus de Epstein-Barr (VEB). En raras ocasiones, este virus causa una enfermedad linfoproliferativa que por lo general se relaciona con la terapia multifarmacológica intensiva del EICH o un TCMH con reducción de células T.
- Infección por adenovirus. La infección por adenovirus es un problema importante en el entorno de un trasplante con reducción de células T; la vigilancia mediante PCR cuantitativa en sangre seguida de terapia con cidofovir o brincidofovir (disponible mediante un protocolo de uso compasivo) ha conducido a una disminución notable de la morbilidad.
- Otros virus. Se han involucrado otros virus en la cistitis hemorrágica (virus BK), la encefalitis y la recuperación precaria del recuento sanguíneo (virus del herpes humano 6), así como en otros problemas clínicos. En un estudio se indicó que las cargas virales elevadas de BK poco después del trasplante (4–7 semanas) quizás estén relacionadas con la reducción a largo plazo de la tasa de filtración glomerular.
La vigilancia vírica minuciosa es esencial durante los procedimientos alogénicos de riesgo alto.
Se pueden presentar infecciones bacterianas tardías en pacientes con vías centrales o pacientes que tienen EICH crónica grave. Estos pacientes son susceptibles a infecciones por microorganismos encapsulados, en particular el neumococo. A pesar de la revacunación, estos pacientes a veces presentan infecciones graves; se recomienda la profilaxis continua hasta que se documente una respuesta serológica a la vacunación. En ocasiones, los pacientes presentan asplenia funcional después de un TCMH alogénico y se recomienda la profilaxis antibiótica. Los pacientes deben continuar recibiendo profilaxis antiinfecciosa (por ejemplo, contra la neumonía por Pneumocystis jirovecii) hasta la recuperación inmunitaria. El tiempo de recuperación inmunitaria no es uniforme, pero oscila de 3 a 9 meses después de un TCMH autógeno y de 9 a 24 meses después de TCMH alogénico sin EICH. Es posible que los pacientes con EICH crónica activa presenten inmunodepresión persistente durante años. Muchos centros hacen un seguimiento de la recuperación del subconjunto de células T después de los trasplantes de médula ósea para determinar el riesgo de infección.
Vacunación después de un trasplante
Los grupos internacionales de trasplantes y enfermedades infecciosas han elaborado directrices específicas para la administración de vacunas después de trasplantes autógenos y alogénicos. No se han realizado estudios comparativos destinados a definir el momento oportuno de la vacunación después del trasplante, pero las directrices de vacunación descritas en el Cuadro 2 conducen a valores de anticuerpos protectores en la mayoría de los pacientes vacunados. En estas directrices se recomienda que los receptores de trasplantes autógenos reciban vacunas 6 meses después de la infusión de células madre y vacunas elaboradas con microbios vivos 24 meses después del trasplante. Los pacientes sometidos a procedimientos alogénicos pueden comenzar las vacunaciones a los 6 meses del trasplante. Sin embargo, en el caso de pacientes que permanecen con inmunodepresión, muchos grupos prefieren esperar hasta 12 meses después del procedimiento o hasta que ya no reciban inmunodepresores.
Se deben analizar las directrices de vacunación cuando se producen brotes de enfermedades endémicas locales o epidémicas. En esos entornos, es posible establecer la vacunación con vacunas inactivadas, teniendo en cuenta que producen respuestas limitadas en el huésped.
| TCMH autógeno | 6 mesesb | 8 mesesb | 12 mesesb | 24 mesesb |
|---|---|---|---|---|
| TCMH alogénico (si no se vacunó en los primeros 12 meses después del TCMH; empezar la vacunación con independencia del estado de la EICH o la inmunodepresión) | 12 mesesb (antes, si ya no recibe inmunodepresores) | 14 mesesb (o 2 meses después de la primera dosis) | 18 mesesb (o 6 meses después de la primera dosis) | 24 mesesb |
| EICH = enfermedad de injerto contra huésped; TCMH = trasplante de células madre hematopoyéticas. | ||||
| aAdaptado de Tomblyn et al., Centros para el Control y la Prevención de Enfermedades, y Kumar et al. | ||||
| bLos tiempos indicados son posteriores al trasplante (día 0). | ||||
| cSe puede usar Tdap si no se dispone de DTap. | ||||
| dEs posible considerar los valores de anticuerpos para pacientes pediátricos y pacientes de EICH que recibieron vacunas mientras se sometían a inmunodepresión (6–8 semanas como mínimo después de la última vacunación). | ||||
| eEn ocasiones, se comienza 4 meses después del TCMH o antes para pacientes con recuentos de CD4 >200/μl o en cualquier momento durante una epidemia. Si se administra <6 meses después de un TCMH, es posible que se necesite una segunda dosis. Los niños menores de 9 años necesitan una segunda dosis 1 mes después de la primera. | ||||
| fConsiderar los valores de anticuerpos antes y después de la vacunación (por lo menos 6–8 semanas después). | ||||
| gPCV 7 a los 24 meses solo para pacientes con EICH; todos los otros pacientes pueden recibir PPV 23. | ||||
| hLos pacientes pediátricos deben recibir 2 dosis con 1 mes de diferencia como mínimo. | ||||
| Vacunas inactivadas | ||||
| Vacuna acelular contra la difteria, el tétanos y la tosferina (DTap) | Xc | Xc | Xc,d | |
| Vacuna contra Haemophilus influenzae (Hib) | X | X | Xd | |
| Vacuna contra la hepatitis B (HepB) | X | X | Xd | |
| Vacuna antipoliomielítica inactivada (IPV) | X | X | Xd | |
| Vacuna antigripal estacional (intramuscular) | Xe | |||
| Vacunas antineumocócicas conjugadas (PCV 7, PCV 13) | Xf | X | Xd,f,g | |
| Vacuna antineumocócica de polisacáridos (PPV 23) | Xd,f,g | |||
| Vacunas con microbios vivos atenuadas (contraindicadas en pacientes con EICH activa o sometidos a inmunodepresión) | ||||
| Vacuna contra el sarampión, la parotiditis y la rubéola | Xd,h | |||
| Opcional: vacunas inactivadas | ||||
| Vacuna contra la hepatitis A | Opcional | |||
| Vacuna antimeningocócica | Xd (para pacientes con riesgo alto) | |||
| Opcional: vacunas con microbios vivos (contraindicadas en pacientes con EICH activa o sometidos a inmunodepresión) | ||||
| Vacuna contra la varicela | Opcional | |||
| Vacuna antirrábica | En caso de exposición, es posible que se considere a los 12–24 meses | |||
| Vacunas contra la fiebre amarilla, la encefalitis transmitida por garrapatas (TBE) y la encefalitis japonesa B | Para viajar a áreas de enfermedad endémica | |||
| Vacunas contraindicadas | ||||
| Vacuna intranasal contra la influenza (vacuna trivalente con virus vivos atenuados) (las personas que conviven con el receptor en el mismo hogar y los cuidadores no deben recibir esta vacuna dentro de las 2 semanas anteriores al contacto con el receptor de un TCMH); vacuna contra el herpes zóster; vacuna contra el bacilo de Calmette y Guérin (BCG); vacuna antipoliomielítica oral (OPV); vacuna contra el cólera; vacuna contra la fiebre tifoidea (oral o intramuscular); vacuna contra el rotavirus. | ||||
Síndrome de obstrucción sinusoidal o enfermedad venoclusiva
Desde el punto de vista patológico, el síndrome de obstrucción sinusoidal o enfermedad venoclusiva (SOS/EVO) se produce como resultado del daño a los sinusoides hepáticos, que provoca obstrucción biliar. Se calculó que este síndrome se presenta en un 15 % a un 40 % de los pacientes pediátricos sometidos a trasplantes mielosupresores.
Los factores de riesgo del SOS/EVO son los siguientes:
- Uso de busulfano (en especial, antes de la vigilancia farmacocinética terapéutica).
- Irradiación corporal total.
- Infecciones graves.
- EICH.
- Disfunción hepática previa causada por hepatitis o sobrecarga de hierro.
Desde el punto de vista clínico, el SOS/EVO se define por lo siguiente:
- Dolor en el cuadrante superior derecho con hepatomegalia.
- Retención hídrica (aumento de peso y ascitis).
- Hiperbilirrubinemia.
Por lo general, el SOS/EVO potencialmente mortal se presenta enseguida después del trasplante y se caracteriza por insuficiencia sistémica multiorgánica. Es posible que se presenten formas más leves y reversibles para las que se anticipa recuperación total. Dado que se notificaron casos de pacientes pediátricos con SOS/EVO grave sin aumento de la bilirrubina, es importante el seguimiento de los pacientes que tienen otros síntomas sin aumento de la bilirrubina.
Prevención y tratamiento del síndrome de obstrucción sinusoidal o enfermedad venoclusiva
Se estudiaron abordajes de prevención y tratamiento, con fármacos como la heparina, la proteína C y la antitrombina III con resultados desiguales. En un estudio retrospectivo pequeño de un solo centro, se observó un beneficio del tratamiento con corticoesteroides, pero se necesita mayor convalidación.
Otro fármaco con actividad demostrada es la defibrotida, una mezcla de oligonucleótidos con efectos antitrombóticos y fibrinolíticos en el endotelio microvascular. En los estudios de defibrotida se observó lo siguiente:
- Reducción de la mortalidad en los pacientes que se trataron con defibrotida por SOS/VOD grave, en comparación con los controles históricos.; [Nivel de evidencia C1]
- Disminución de la mortalidad por SOS/EVO relacionada con la iniciación temprana del tratamiento con defibrotida justo después de que se cumplen los criterios diagnósticos de SOS/EVO.[Nivel de evidencia B4]
- Eficacia para disminuir la incidencia de SOS/EVO cuando se administra con finalidad profiláctica.[Nivel de evidencia A1] No obstante, se cerró debido a la falta de eficacia, lo que pone en duda la validez del uso profiláctico de la defibrotida.
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el uso de la defibrotida para el tratamiento de pacientes con SOS/EVO hepática, con disfunción renal o pulmonar después de un TCMH.
La British Society for Blood and Marrow Transplantation (BSBMT) publicó recomendaciones, a partir de evidencia científica, para el diagnóstico y tratamiento del SOS/EVO. En estas recomendaciones se reserva la biopsia para casos difíciles y se indica una vía de acceso transyugular. La BSBMT aconseja el uso de defibrotida para prevenir el SOS/EVO (la profilaxis con defibrotida no es parte de la indicación actual de la FDA), pero considera que no hay suficientes datos para sustentar la administración de prostaglandina E1, pentoxifilina o antitrombina. Para el tratamiento del SOS/EVO, recomienda el abordaje intensivo a fin de recuperar el equilibrio hidroelectrolítico, la participación temprana de especialistas en medicina intensiva y gastroenterología, así como el uso de defibrotida y, quizás, metilprednisolona. Sin embargo se concluyó que no hay suficiente evidencia que sustente la administración del activador del plasminógeno tisular o de N-acetilcisteína. El Pediatric Blood and Marrow Transplant Consortium, que trabajó junto con el grupo Pediatric Acute Lung Injury and Sepsis Investigators publicó recomendaciones de consenso más detalladas para el diagnóstico y tratamiento del SOS/EVO en niños después de recibir un TCMH.
Microangiopatía trombótica relacionada con el trasplante
Aunque la microangiopatía trombótica relacionada con el trasplante (TA-TMA) imita la presentación clínica de un síndrome urémico hemolítico, su causa y evolución clínica difieren de las de otras enfermedades similares al síndrome urémico hemolítico. En estudios, este síndrome se relacionó con la desregulación de las vías del complemento. La TA-TMA se ha vinculado con mayor frecuencia al uso de los inhibidores de la calcineurina, tacrólimus y ciclosporina, y se ha observado que se presenta con más frecuencia cuando cualquiera de estos dos fármacos se usa en combinación con el sirólimus.
Los criterios diagnósticos para este síndrome se estandarizaron y son los siguientes:
- Presencia de esquistocitos en un frotis de sangre periférica.
- Aumento de la deshidrogenasa láctica (LDH).
- Disminución de la haptoglobina.
- Trombocitopenia, con anemia o sin esta.
Los síntomas indicativos compatibles con la enfermedad, pero no necesarios para el diagnóstico, incluyen un deterioro súbito del funcionamiento renal y síntomas neurológicos.
Evidencia (efecto de la TA-TMA en los desenlaces de TCMH):
- En un estudio multicéntrico de TA-TMA en pacientes pediátricos se usaron los siguientes parámetros para definir la TA-TMA.
- Características histológicas que demuestran la TA-TMA.
- Presencia de al menos 4 de los siguientes marcadores, clínicos o de laboratorio, diagnósticos para TA-TMA:
- Concentración de LDH superior al valor de referencia para la edad.
- Presencia de esquistocitos en frotis de sangre periférica.
- Trombocitopenia de nueva aparición o necesidad de transfundir plaquetas.
- Anemia de nueva aparición o necesidad de transfundir glóbulos rojos.
- Hipertensión superior al 99 % del valor normal para la edad (edad <18 años) o superior a 140/90 mm Hg (edad ≥18 años) que requiere 2 o más antihipertensivos.
- Proteinuria ≥30 mg/dl en análisis aleatorio de orina en 2 oportunidades o razón de proteinuria/creatinuria >1 mg/mg con un análisis aleatorio de orina.
- Activación del complemento terminal: Aumento de sC5b-9 en plasma por encima del límite normal (≥244 ng/ml).
- En el estudio se obtuvieron los siguientes resultados:
- De 614 pacientes consecutivos que se sometieron a TCMH alogénico o autógeno, el 19 % de los receptores de trasplantes alogénicos y el 10 % de los receptores de trasplantes autólogos presentaron TA-TMA.
- Los pacientes que presentaron TA-TMA tuvieron tasas superiores de EICH aguda y de EICH resistente a corticoesteroides, ingresos a la unidad de cuidados intensivos, ventilación invasiva, derrames pericárdicos, hipertensión pulmonar, diálisis o terapia de reemplazo renal continua, lesión renal aguda y enfermedad venooclusiva.
- Entre los pacientes que se sometieron a TCMH alogénico, la mortalidad relacionada con el tratamiento durante los 6 primeros meses fue significativamente más alta en los pacientes que presentaron TA-TMA (20 vs. 3 %; P ≤ 0,0001).
- Entre los pacientes que se sometieron a TCMH autógeno, la tasa de supervivencia general (SG) durante los 6 primeros meses fue significativamente más baja en los pacientes con TA-TMA que en aquellos sin TA-TMA (79 vs. 98 %; P = 0,001).
Tratamiento de la microangiopatía trombótica relacionada con el trasplante
El tratamiento de la microangiopatía trombótica relacionada con el trasplante (TA-TMA) incluye las siguientes opciones:
- Interrupción de la administración de inhibidores de la calcineurina y la sustitución con otros inmunodepresores en caso necesario.
- Tratamiento cuidadoso de la hipertensión y el daño renal mediante diálisis, si fuera necesario.
Por lo general, el pronóstico para la normalización del funcionamiento renal es precario cuando la causa de enfermedad es solo el uso de inhibidores de la calcineurina; sin embargo, la mayoría de las TA-TMA vinculadas a la combinación de un inhibidor de la calcineurina y sirólimus se corrigieron después de suspender este último y, en algunos casos, después de suspender ambos fármacos.
Hay cierta evidencia que indica una función de la modulación del complemento (C5, terapia con eculizumab) para preservar el funcionamiento renal. Está en curso una evaluación adicional de la función de este fármaco para el tratamiento de esta complicación. Aunque no hay ensayos aleatorizados ni prospectivos en los que se haya usado el eculizumab para tratar la TA-TMA, existen datos publicados de estudios retrospectivos institucionales y multicéntricos. En el pasado, la tasa de supervivencia a 1 año para los pacientes con TA-TMA que no recibieron tratamiento fue de alrededor del 20 %. En un estudio de un solo centro se observó una tasa de SG a 1 año del 66 % con el tratamiento con eculizumab. En un estudio multicéntrico se notificó una tasa de SG a 6 meses del 47 % con el tratamiento con eculizumab.
Síndrome de neumonía idiopática
El síndrome de neumonía idiopática se caracteriza por una lesión pulmonar difusa no infecciosa que se presenta entre 14 y 90 días después de la infusión de células de un donante. Las causas posibles incluyen efectos tóxicos directos de los regímenes de acondicionamiento e infecciones ocultas que conducen a la secreción de concentraciones altas de citocinas inflamatorias en los alvéolos.
La incidencia de esta complicación está disminuyendo, quizás debido a regímenes preparatorios menos intensivos, mejor compatibilidad de HLA y mejor identificación de las infecciones ocultas mediante pruebas de PCR de muestras sanguíneas y broncoalveolares. Si bien se notificaron tasas de mortalidad del 50 % al 70 %, estos cálculos se obtuvieron a mediados de la década de 1990 y es posible que los desenlaces hayan mejorado.
Cuando no se documenta la presencia de organismos infecciosos, los criterios para el diagnóstico son las siguientes manifestaciones:
- Neumonía.
- Indicios radiográficos de infiltración no lobular.
- Funcionamiento pulmonar anómalo.
Es importante la evaluación temprana mediante lavado broncoalveolar para descartar una infección.
Tratamiento del síndrome de neumonía idiopática
El tratamiento tradicional consistió en dosis altas de metilprednisolona y apoyo pulmonar.
El etanercept es una proteína de fusión soluble que enlaza el dominio extracelular de unión al ligando del receptor del factor de necrosis tumoral (TNF)–α con la región Fc del anticuerpo inmunoglobulina G1 (IgG1). Este fármaco actúa impidiendo la señalización del TNF–α. En estudios realizados en un solo centro, la adición de etanercept a las terapias con corticoesteroides ha mostrado resultados prometedores a corto plazo (extubación, mejora de la supervivencia a corto plazo). En un ensayo grande de fase II de este abordaje en pacientes pediátricos, se observaron resultados prometedores, con tasas de SG del 89 % a 1 mes y del 63 % a los 12 meses.
Citopenias autoinmunitarias
Las citopenias autoinmunitarias (CAI) posteriores al TCMH alogénico pueden estar restringidas a 1 linaje celular (por ejemplo, anemia hemolítica autoinmunitaria), 2 linajes celulares o 3 linajes celulares. La mayoría de los datos acerca de CAI después de un TCMH en pacientes pediátricos se notificaron a partir de experiencias de un solo centro; hubo entre 20 y 30 casos en un periodo de 10 a 20 años. La incidencia de CAI es del 5 % después del TCMH alogénico. Los factores de riesgo de CAI son edad inferior a 10 años en el momento del trasplante e indicaciones no cancerosas para el TCMH. Al menos en 1 estudio se identificó el uso de seroterapia, el uso de sangre de cordón umbilical como fuente donante y la EICH grave como factores de riesgo, pero estos hallazgos no se confirmaron en otros estudios. En 1 estudio se demostró que los pacientes que presentan CAI tienen desenlaces más precarios que aquellos que no presentan CAI. Sin embargo, en otros estudios no se observaron desenlaces más precarios.
Tratamiento de las citopenias autoinmunitarias
La terapia de primera línea más común para las CAI son los corticoesteroides. Este tratamiento es eficaz en solo el 15 % de los pacientes, y se han usado otros inmunodepresores o anticuerpos monoclonales dirigidos a células B. La inmunoglobulina intravenosa se usa con frecuencia como tratamiento para las CAI o para el reemplazo con inmunoglobulinas.
Trastorno linfoproliferativo relacionado con el virus de Epstein-Barr
Luego de un TCMH, la infección por el VEB aumenta durante la niñez desde casi un 40 % en niños de 4 años a más de un 80 % en adolescentes. Los pacientes con antecedentes de infección por el VEB tienen riesgo de reactivación del virus cuando se someten a procedimientos de TCMH que producen linfopenia intensa y prolongada (procedimientos con reducción de células T, uso de globulina antitimocítica o alemtuzumab y, en menor grado, uso de sangre de cordón umbilical).
Las características de la reactivación del VEB oscilan entre un aumento aislado de los valores cuantitativos del VEB en el torrente sanguíneo medidos mediante PCR hasta una enfermedad monoclonal activa con linfadenopatía marcada que se presenta como linfoma (trastorno linfoproliferativo).
Tratamiento del trastorno linfoproliferativo relacionado con el virus de Epstein-Barr
En algunos casos, la reactivación aislada en el torrente sanguíneo del VEB mejora sin tratamiento a medida que se corrige el funcionamiento inmunitario; sin embargo, el trastorno linfoproliferativo exige un tratamiento más intensivo.
El tratamiento del trastorno linfoproliferativo relacionado con el VEB dependió en el pasado de la reducción de la inmunodepresión y el tratamiento con fármacos de quimioterapia como la ciclofosfamida. El trastorno linfoproliferativo relacionado con el VEB positivo para CD20 y la reactivación del VEB responden a la terapia con rituximab, un anticuerpo monoclonal contra el CD20. Además, en algunos centros se observó que la administración terapéutica o profiláctica de células T citotóxicas específicas para el VEB fue eficaz para prevenir o tratar esta complicación.
Una mejor comprensión del riesgo de reactivación del VEB, la vigilancia temprana y el tratamiento intensivo disminuyeron significativamente el riesgo de mortalidad por esta complicación, que representa un reto durante la atención.
Enfermedad de injerto contra huésped aguda
La EICH se produce cuando hay activación inmunitaria de los linfocitos del donante desencadenada por incompatibilidades de HLA mayores o menores presentes en los tejidos del receptor. La EICH aguda se suele presentar dentro de los 3 primeros meses posteriores al trasplante, aunque se observó EICH aguda diferida con abordajes de acondicionamiento de intensidad reducida y no mielosupresores cuando se demora el logro de un grado alto de quimerismo completo del donante.
Normalmente, la EICH aguda se presenta con por lo menos 1 de las 3 manifestaciones siguientes:
- Exantema.
- Hiperbilirrubinemia.
- Diarrea secretoria.
La EICH aguda se clasifica de acuerdo con la gravedad del compromiso cutáneo, hepático y gastrointestinal, y luego se computan los puntajes de las 3 áreas para obtener un grado general que tiene importancia pronóstica (consultar los Cuadros 3 y 4). Los pacientes con EICH aguda de grados III o IV tienen un riesgo más alto de mortalidad, por lo general, debida al daño sistémico de órganos causado por infecciones o por una EICH aguda progresiva que, a veces, es resistente al tratamiento.
| Estadio | Compromiso cutáneo | Compromiso hepático (bilirrubina)b | Compromiso gastrointestinal (producción diaria de materia fecal)c | |
|---|---|---|---|---|
| Adultos | Niños | |||
| ASC = área de superficie corporal; GI = gastrointestinal. | ||||
| aAdaptado de Harris et al. | ||||
| bNo hay modificación de la estadificación hepática para otras causas de hiperbilirrubinemia. | ||||
| cPara la estadificación del compromiso gastrointestinal: los valores de producción de materia fecal en adultos se deben usar para pacientes que pesan >50 kg. Usar el promedio de 3 días para la estadificación gastrointestinal de acuerdo con la producción de materia fecal. Si hay mezcla de materia fecal y orina, se presume que la producción de materia fecal corresponde a 50 % de la mezcla total. | ||||
| dSi la biopsia de colon o recto es positiva para compromiso, pero la producción de materia fecal es de <500 ml/día (<10 ml/kg/día), entonces el compromiso gastrointestinal se considera en estadio 0. | ||||
| ePara el estadio gastrointestinal 4: el término dolor abdominal intenso corresponderá cuando el paciente manifiesta uno de los siguientes dos casos: a) dolor que solo se controla con opioides o una dosis más alta del opioide en uso, o b) dolor que afecta significativamente el estado funcional, de acuerdo con lo que se determine en la evaluación médica. | ||||
| 0 | EICH sin exantema | <2 mg/dl | <500 ml o <3 episodios/día | <10 ml/kg o <4 episodios/día |
| 1 | Exantema maculopapular <25 % ASC | 2–3 mg/dl | 500–999 mld o 3–4 episodios/día | 10–19,9 ml/kg o 4–6 episodios/día, náuseas y vómitos persistentes, o anorexia, con una biopsia gastrointestinal superior positiva para compromiso |
| 2 | Exantema maculopapular 25–50 % de ASC | 3,1–6 mg/dl | 1000–1500 m o 5–7 episodios/día | 20–30 m/kg o 7–10 episodios/día |
| 3 | Exantema maculopapular <50% de ASC | 6,1–15 mg/dl | >1500 ml o >7 episodios/día | >30 ml/kg o >10 episodios/día |
| 4 | Eritrodermia generalizada con ampollas y descamación >5 % de ASC | >15 mg/dl | Dolor abdominal intensoe con íleo o sin este, o sangre visible en la materia fecal (cualquier volumen de materia fecal) | Dolor abdominal intensoe con íleo o sin este, o sangre visible en la materia fecal (cualquier volumen de materia fecal) |
| GI = gastrointestinal. | |
| Grado 0: | Ningún órgano en estadios 1–4 |
| Grado I: | Estadios 1–2 para el compromiso cutáneo, sin compromiso hepático o intestinal |
| Grado II: | Estadio 3 para el compromiso cutáneo o estadio 1 para el compromiso hepático o gastrointestinal |
| Grado III: | Estadios 0–3 para el compromiso cutáneo, con estadio 2–3 para el compromiso hepático o gastrointestinal |
| Grado IV: | Estadio 4 para el compromiso cutáneo, hepático o gastrointestinal |
Debido a la variación en los desenlaces de los pacientes con diferentes grados de EICH aguda, los investigadores trataron de definir una determinación más precisa de los riesgos de EICH aguda mediante biomarcadores séricos. En un estudio en el que se incluyeron adultos y niños se usó un puntaje calculado de acuerdo a la concentración de 3 marcadores biológicos (receptor 1 del factor de necrosis tumoral [TNFR1], supresión de la tumorigenicidad 2 [ST2] y proteína 3-α regeneradora derivada de islotes [REG3-α]) medidos al inicio de la EICH aguda. Los investigadores pudieron identificar a los pacientes con riesgo bajo (8 %), intermedio (27 %), y alto (46 %, P< 0,0001) de muerte en los siguientes 6 meses. El puntaje de los biomarcadores fue más sensible y específico para predecir la supervivencia que los estadios clínicos. Con el perfeccionamiento adicional del algoritmo se demostró que con la medición de solo 2 biomarcadores (ST2 y REG3-α) se logra predecir los desenlaces de manera fiable. Además, después de 4 semana de tratamiento, los cambios en los puntajes de los biomarcadores permitieron mejorar aún más la predicción de la supervivencia. Estos hallazgos dieron lugar a varios estudios dirigidos a subgrupos de pacientes con puntajes de biomarcadores de riesgo alto o de riesgo bajo con EICH aguda, y sirven de referencia para definir el momento oportuno y la intensidad de los tratamientos de la EICH aguda.
Prevención y tratamiento de la enfermedad de injerto contra huésped aguda
Es posible reducir la morbilidad y la mortalidad por EICH aguda con fármacos inmunodepresores administrados como profilaxis o mediante la reducción de las células T de los injertos, ya sea ex vivo por extracción real de las células de un injerto, o in vivo con anticuerpos antilinfocitarios (globulina antitimocítica o anti-CD52 [alemtuzumab]).
La eliminación completa de la EICH aguda con abordajes de reducción intensiva de células T, en general, produjo un aumento de las recaídas, la morbilidad infecciosa y los trastornos linfoproliferativos relacionados con el VEB. Debido a estos resultados, la función de casi toda la profilaxis de la EICH durante un TCMH es intentar equilibrar el riesgo mediante una inmunodepresión suficiente como para prevenir una EICH aguda grave, pero sin eliminar por completo el riesgo de esta enfermedad.
Los abordajes para la prevención de la EICH en injertos sin reducción de células T han sido los siguientes:; [Nivel de evidencia C1]
- Administración intermitente de metotrexato.
- Inhibidor de la calcineurina (por ejemplo, ciclosporina o tacrólimus).
- Combinación de un inhibidor de la calcineurina con metotrexato (el abordaje actual que más se utiliza en pediatría).
- Distintas combinaciones de un inhibidor de la calcineurina con corticoesteroides o micofenolato mofetilo.
- Tratamiento que no incluya un inhibidor de la calcineurina (reducción intensiva de células T, administración de ciclofosfamida después del trasplante, etc.). Se han elaborado abordajes en los que no se usan inhibidores de la calcineurina y se están utilizando cada vez más.
Enfermedad de injerto contra huésped aguda resistente al tratamiento con corticoesteroides
Cuando se presenta una EICH aguda grave, se suele utilizar metilprednisolona como terapia de primera línea. Los pacientes con EICH aguda que son resistentes a esta terapia tienen un pronóstico precario, pero un buen porcentaje de casos responden a fármacos de segunda línea (por ejemplo, micofenolato mofetilo, infliximab, pentostatina, sirólimus o fotoaféresis extracorpórea). El ruxolitinib se aprobó en 2019 para el tratamiento de niños de 12 años o más con EICH aguda resistente al tratamiento con corticoesteroides; la tasa de respuesta general fue del 55 % y la tasa de respuesta completa fue del 27 % a los 28 de haber iniciado el tratamiento. No se han realizado ensayos comparativos de estos fármacos; por lo tanto, no se ha determinado la mejor opción de tratamiento para la EICH resistente a los corticoesteroides.
References
- Antin JH: Immune reconstitution: the major barrier to successful stem cell transplantation. Biol Blood Marrow Transplant 11 (2 Suppl 2): 43-5, 2005.
- Fry TJ, Mackall CL: Immune reconstitution following hematopoietic progenitor cell transplantation: challenges for the future. Bone Marrow Transplant 35 (Suppl 1): S53-7, 2005.
- Wingard JR, Majhail NS, Brazauskas R, et al.: Long-term survival and late deaths after allogeneic hematopoietic cell transplantation. J Clin Oncol 29 (16): 2230-9, 2011.
- Bunin N, Small T, Szabolcs P, et al.: NCI, NHLBI/PBMTC first international conference on late effects after pediatric hematopoietic cell transplantation: persistent immune deficiency in pediatric transplant survivors. Biol Blood Marrow Transplant 18 (1): 6-15, 2012.
- Burik JH, Freifeld AG: Infection in the severely immunocompromised patient. In: Abeloff MD, Armitage JO, Niederhuber JE, et al.: Clinical Oncology. 3rd ed. Elsevier, Churchill Livingstone, 2004, pp 941-56.
- Tomblyn M, Chiller T, Einsele H, et al.: Guidelines for preventing infectious complications among hematopoietic cell transplantation recipients: a global perspective. Biol Blood Marrow Transplant 15 (10): 1143-238, 2009.
- Centers for Disease Control and Prevention, Infectious Disease Society of America, American Society of Blood and Marrow Transplantation: Guidelines for preventing opportunistic infections among hematopoietic stem cell transplant recipients. MMWR Recomm Rep 49 (RR-10): 1-125, CE1-7, 2000.
- Levy ER, Musick L, Zinter MS, et al.: Safe and Effective Prophylaxis with Bimonthly Intravenous Pentamidine in the Pediatric Hematopoietic Stem Cell Transplant Population. Pediatr Infect Dis J 35 (2): 135-41, 2016.
- Hiwarkar P, Amrolia P, Sivaprakasam P, et al.: Brincidofovir is highly efficacious in controlling adenoviremia in pediatric recipients of hematopoietic cell transplant. Blood 129 (14): 2033-2037, 2017.
- Wychera C, Imlay HN, Duke ER, et al.: BK Viremia and Changes in Estimated Glomerular Filtration Rate in Children and Young Adults after Hematopoietic Cell Transplantation. Transplant Cell Ther 29 (3): 187.e1-187.e8, 2023.
- Rubin LG, Levin MJ, Ljungman P, et al.: 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis 58 (3): e44-100, 2014.
- Cordonnier C, Einarsdottir S, Cesaro S, et al.: Vaccination of haemopoietic stem cell transplant recipients: guidelines of the 2017 European Conference on Infections in Leukaemia (ECIL 7). Lancet Infect Dis 19 (6): e200-e212, 2019.
- Kumar D, Chen MH, Welsh B, et al.: A randomized, double-blind trial of pneumococcal vaccination in adult allogeneic stem cell transplant donors and recipients. Clin Infect Dis 45 (12): 1576-82, 2007.
- Reiss U, Cowan M, McMillan A, et al.: Hepatic venoocclusive disease in blood and bone marrow transplantation in children and young adults: incidence, risk factors, and outcome in a cohort of 241 patients. J Pediatr Hematol Oncol 24 (9): 746-50, 2002.
- Cesaro S, Pillon M, Talenti E, et al.: A prospective survey on incidence, risk factors and therapy of hepatic veno-occlusive disease in children after hematopoietic stem cell transplantation. Haematologica 90 (10): 1396-404, 2005.
- Bearman SI: The syndrome of hepatic veno-occlusive disease after marrow transplantation. Blood 85 (11): 3005-20, 1995.
- Myers KC, Dandoy C, El-Bietar J, et al.: Veno-occlusive disease of the liver in the absence of elevation in bilirubin in pediatric patients after hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 21 (2): 379-81, 2015.
- Ruutu T, Eriksson B, Remes K, et al.: Ursodeoxycholic acid for the prevention of hepatic complications in allogeneic stem cell transplantation. Blood 100 (6): 1977-83, 2002.
- Myers KC, Lawrence J, Marsh RA, et al.: High-dose methylprednisolone for veno-occlusive disease of the liver in pediatric hematopoietic stem cell transplantation recipients. Biol Blood Marrow Transplant 19 (3): 500-3, 2013.
- Richardson PG, Murakami C, Jin Z, et al.: Multi-institutional use of defibrotide in 88 patients after stem cell transplantation with severe veno-occlusive disease and multisystem organ failure: response without significant toxicity in a high-risk population and factors predictive of outcome. Blood 100 (13): 4337-43, 2002.
- Corbacioglu S, Kernan N, Lehmann L, et al.: Defibrotide for the treatment of hepatic veno-occlusive disease in children after hematopoietic stem cell transplantation. Expert Rev Hematol 5 (3): 291-302, 2012.
- Richardson PG, Soiffer RJ, Antin JH, et al.: Defibrotide for the treatment of severe hepatic veno-occlusive disease and multiorgan failure after stem cell transplantation: a multicenter, randomized, dose-finding trial. Biol Blood Marrow Transplant 16 (7): 1005-17, 2010.
- Dignan FL, Wynn RF, Hadzic N, et al.: BCSH/BSBMT guideline: diagnosis and management of veno-occlusive disease (sinusoidal obstruction syndrome) following haematopoietic stem cell transplantation. Br J Haematol 163 (4): 444-57, 2013.
- Strouse C, Richardson P, Prentice G, et al.: Defibrotide for Treatment of Severe Veno-Occlusive Disease in Pediatrics and Adults: An Exploratory Analysis Using Data from the Center for International Blood and Marrow Transplant Research. Biol Blood Marrow Transplant 22 (7): 1306-1312, 2016.
- Richardson PG, Smith AR, Triplett BM, et al.: Earlier defibrotide initiation post-diagnosis of veno-occlusive disease/sinusoidal obstruction syndrome improves Day +100 survival following haematopoietic stem cell transplantation. Br J Haematol 178 (1): 112-118, 2017.
- Corbacioglu S, Cesaro S, Faraci M, et al.: Defibrotide for prophylaxis of hepatic veno-occlusive disease in paediatric haemopoietic stem-cell transplantation: an open-label, phase 3, randomised controlled trial. Lancet 379 (9823): 1301-9, 2012.
- Grupp SA, Corbacioglu S, Kang HJ, et al.: Defibrotide plus best standard of care compared with best standard of care alone for the prevention of sinusoidal obstruction syndrome (HARMONY): a randomised, multicentre, phase 3 trial. Lancet Haematol 10 (5): e333-e345, 2023.
- Ruutu T, Juvonen E, Remberger M, et al.: Improved survival with ursodeoxycholic acid prophylaxis in allogeneic stem cell transplantation: long-term follow-up of a randomized study. Biol Blood Marrow Transplant 20 (1): 135-8, 2014.
- Bajwa RPS, Mahadeo KM, Taragin BH, et al.: Consensus Report by Pediatric Acute Lung Injury and Sepsis Investigators and Pediatric Blood and Marrow Transplantation Consortium Joint Working Committees: Supportive Care Guidelines for Management of Veno-Occlusive Disease in Children and Adolescents, Part 1: Focus on Investigations, Prophylaxis, and Specific Treatment. Biol Blood Marrow Transplant 23 (11): 1817-1825, 2017.
- Mahadeo KM, McArthur J, Adams RH, et al.: Consensus Report by the Pediatric Acute Lung Injury and Sepsis Investigators and Pediatric Blood and Marrow Transplant Consortium Joint Working Committees on Supportive Care Guidelines for Management of Veno-Occlusive Disease in Children and Adolescents: Part 2-Focus on Ascites, Fluid and Electrolytes, Renal, and Transfusion Issues. Biol Blood Marrow Transplant 23 (12): 2023-2033, 2017.
- Ovchinsky N, Frazier W, Auletta JJ, et al.: Consensus Report by the Pediatric Acute Lung Injury and Sepsis Investigators and Pediatric Blood and Marrow Transplantation Consortium Joint Working Committees on Supportive Care Guidelines for Management of Veno-Occlusive Disease in Children and Adolescents, Part 3: Focus on Cardiorespiratory Dysfunction, Infections, Liver Dysfunction, and Delirium. Biol Blood Marrow Transplant 24 (2): 207-218, 2018.
- Jodele S, Licht C, Goebel J, et al.: Abnormalities in the alternative pathway of complement in children with hematopoietic stem cell transplant-associated thrombotic microangiopathy. Blood 122 (12): 2003-7, 2013.
- Cutler C, Henry NL, Magee C, et al.: Sirolimus and thrombotic microangiopathy after allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 11 (7): 551-7, 2005.
- Ho VT, Cutler C, Carter S, et al.: Blood and marrow transplant clinical trials network toxicity committee consensus summary: thrombotic microangiopathy after hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 11 (8): 571-5, 2005.
- Dandoy CE, Rotz S, Alonso PB, et al.: A pragmatic multi-institutional approach to understanding transplant-associated thrombotic microangiopathy after stem cell transplant. Blood Adv 5 (1): 1-11, 2021.
- Jodele S, Fukuda T, Vinks A, et al.: Eculizumab therapy in children with severe hematopoietic stem cell transplantation-associated thrombotic microangiopathy. Biol Blood Marrow Transplant 20 (4): 518-25, 2014.
- Jodele S, Fukuda T, Mizuno K, et al.: Variable Eculizumab Clearance Requires Pharmacodynamic Monitoring to Optimize Therapy for Thrombotic Microangiopathy after Hematopoietic Stem Cell Transplantation. Biol Blood Marrow Transplant 22 (2): 307-315, 2016.
- Schoettler M, Lehmann L, Li A, et al.: Thrombotic Microangiopathy Following Pediatric Autologous Hematopoietic Cell Transplantation: A Report of Significant End-Organ Dysfunction in Eculizumab-Treated Survivors. Biol Blood Marrow Transplant 25 (5): e163-e168, 2019.
- Jodele S, Dandoy CE, Lane A, et al.: Complement blockade for TA-TMA: lessons learned from a large pediatric cohort treated with eculizumab. Blood 135 (13): 1049-1057, 2020.
- Svec P, Elfeky R, Galimard JE, et al.: Use of eculizumab in children with allogeneic haematopoietic stem cell transplantation associated thrombotic microangiopathy - a multicentre retrospective PDWP and IEWP EBMT study. Bone Marrow Transplant 58 (2): 129-141, 2023.
- Kantrow SP, Hackman RC, Boeckh M, et al.: Idiopathic pneumonia syndrome: changing spectrum of lung injury after marrow transplantation. Transplantation 63 (8): 1079-86, 1997.
- Clark JG, Hansen JA, Hertz MI, et al.: NHLBI workshop summary. Idiopathic pneumonia syndrome after bone marrow transplantation. Am Rev Respir Dis 147 (6 Pt 1): 1601-6, 1993.
- Yanik GA, Ho VT, Levine JE, et al.: The impact of soluble tumor necrosis factor receptor etanercept on the treatment of idiopathic pneumonia syndrome after allogeneic hematopoietic stem cell transplantation. Blood 112 (8): 3073-81, 2008.
- Yanik GA, Grupp SA, Pulsipher MA, et al.: TNF-receptor inhibitor therapy for the treatment of children with idiopathic pneumonia syndrome. A joint Pediatric Blood and Marrow Transplant Consortium and Children's Oncology Group Study (ASCT0521). Biol Blood Marrow Transplant 21 (1): 67-73, 2015.
- Szanto CL, Langenhorst J, de Koning C, et al.: Predictors for Autoimmune Cytopenias after Allogeneic Hematopoietic Cell Transplantation in Children. Biol Blood Marrow Transplant 26 (1): 114-122, 2020.
- Koo J, Giller RH, Quinones R, et al.: Autoimmune cytopenias following allogeneic hematopoietic stem cell transplant in pediatric patients: Response to therapy and late effects. Pediatr Blood Cancer 67 (9): e28591, 2020.
- O'Brien TA, Eastlund T, Peters C, et al.: Autoimmune haemolytic anaemia complicating haematopoietic cell transplantation in paediatric patients: high incidence and significant mortality in unrelated donor transplants for non-malignant diseases. Br J Haematol 127 (1): 67-75, 2004.
- Gerritsen EJ, Stam ED, Hermans J, et al.: Risk factors for developing EBV-related B cell lymphoproliferative disorders (BLPD) after non-HLA-identical BMT in children. Bone Marrow Transplant 18 (2): 377-82, 1996.
- Shapiro RS, McClain K, Frizzera G, et al.: Epstein-Barr virus associated B cell lymphoproliferative disorders following bone marrow transplantation. Blood 71 (5): 1234-43, 1988.
- Brunstein CG, Weisdorf DJ, DeFor T, et al.: Marked increased risk of Epstein-Barr virus-related complications with the addition of antithymocyte globulin to a nonmyeloablative conditioning prior to unrelated umbilical cord blood transplantation. Blood 108 (8): 2874-80, 2006.
- Blaes AH, Cao Q, Wagner JE, et al.: Monitoring and preemptive rituximab therapy for Epstein-Barr virus reactivation after antithymocyte globulin containing nonmyeloablative conditioning for umbilical cord blood transplantation. Biol Blood Marrow Transplant 16 (2): 287-91, 2010.
- Kuehnle I, Huls MH, Liu Z, et al.: CD20 monoclonal antibody (rituximab) for therapy of Epstein-Barr virus lymphoma after hemopoietic stem-cell transplantation. Blood 95 (4): 1502-5, 2000.
- Styczynski J, Gil L, Tridello G, et al.: Response to rituximab-based therapy and risk factor analysis in Epstein Barr Virus-related lymphoproliferative disorder after hematopoietic stem cell transplant in children and adults: a study from the Infectious Diseases Working Party of the European Group for Blood and Marrow Transplantation. Clin Infect Dis 57 (6): 794-802, 2013.
- Liu Z, Savoldo B, Huls H, et al.: Epstein-Barr virus (EBV)-specific cytotoxic T lymphocytes for the prevention and treatment of EBV-associated post-transplant lymphomas. Recent Results Cancer Res 159: 123-33, 2002.
- Bollard CM, Heslop HE: T cells for viral infections after allogeneic hematopoietic stem cell transplant. Blood 127 (26): 3331-40, 2016.
- Ferrara JL, Levine JE, Reddy P, et al.: Graft-versus-host disease. Lancet 373 (9674): 1550-61, 2009.
- Przepiorka D, Weisdorf D, Martin P, et al.: 1994 Consensus Conference on Acute GVHD Grading. Bone Marrow Transplant 15 (6): 825-8, 1995.
- Harris AC, Young R, Devine S, et al.: International, Multicenter Standardization of Acute Graft-versus-Host Disease Clinical Data Collection: A Report from the Mount Sinai Acute GVHD International Consortium. Biol Blood Marrow Transplant 22 (1): 4-10, 2016.
- Levine JE, Braun TM, Harris AC, et al.: A prognostic score for acute graft-versus-host disease based on biomarkers: a multicentre study. Lancet Haematol 2 (1): e21-9, 2015.
- Srinagesh HK, Özbek U, Kapoor U, et al.: The MAGIC algorithm probability is a validated response biomarker of treatment of acute graft-versus-host disease. Blood Adv 3 (23): 4034-4042, 2019.
- Kanakry CG, O'Donnell PV, Furlong T, et al.: Multi-institutional study of post-transplantation cyclophosphamide as single-agent graft-versus-host disease prophylaxis after allogeneic bone marrow transplantation using myeloablative busulfan and fludarabine conditioning. J Clin Oncol 32 (31): 3497-505, 2014.
- Bertaina A, Merli P, Rutella S, et al.: HLA-haploidentical stem cell transplantation after removal of αβ+ T and B cells in children with nonmalignant disorders. Blood 124 (5): 822-6, 2014.
- Jacoby E, Chen A, Loeb DM, et al.: Single-Agent Post-Transplantation Cyclophosphamide as Graft-versus-Host Disease Prophylaxis after Human Leukocyte Antigen-Matched Related Bone Marrow Transplantation for Pediatric and Young Adult Patients with Hematologic Malignancies. Biol Blood Marrow Transplant 22 (1): 112-8, 2016.
- Jacobsohn DA: Acute graft-versus-host disease in children. Bone Marrow Transplant 41 (2): 215-21, 2008.
- Deeg HJ: How I treat refractory acute GVHD. Blood 109 (10): 4119-26, 2007.
- Jagasia M, Perales MA, Schroeder MA, et al.: Ruxolitinib for the treatment of steroid-refractory acute GVHD (REACH1): a multicenter, open-label phase 2 trial. Blood 135 (20): 1739-1749, 2020.
- Laisne L, Neven B, Dalle JH, et al.: Ruxolitinib in children with steroid-refractory acute graft-versus-host disease: A retrospective multicenter study of the pediatric group of SFGM-TC. Pediatr Blood Cancer 67 (9): e28233, 2020.
Enfermedad de injerto contra huésped crónica
La EICH crónica es un síndrome que compromete uno o varios sistemas orgánicos, con características clínicas que se asemejan a las de una enfermedad autoinmunitaria. La EICH crónica se suele observar por primera vez después de 2 a 12 meses de un trasplante de células madre hematopoyéticas (TCMH). Tradicionalmente, los síntomas que se presentaban después de 100 días del TCMH se consideraban EICH crónica y los síntomas que se presentaban antes de los 100 días del TCMH se consideraban EICH aguda. Debido a que algunos abordajes del TCMH pueden producir el inicio tardío de una EICH aguda, y las manifestaciones diagnósticas para la EICH crónica se pueden presentar antes de los 100 días, se describieron los siguientes 3 tipos diferenciados de EICH crónica:
- EICH crónica clásica: se presenta con diagnóstico o características distintivas de la EICH crónica (consultar los Cuadros 5–9) después de un antecedente de EICH aguda resuelta.
- Síndrome superpuesto: EICH en curso cuando se presentan manifestaciones diagnósticas de EICH crónica y persisten los síntomas de EICH aguda.
- EICH crónica de novo: EICH de nueva aparición que se suele presentar al cabo de por lo menos 2 meses del trasplante, con características diagnósticas o distintivas de EICH crónica, y sin antecedentes o características de EICH aguda.
Manifestaciones orgánicas de la enfermedad de injerto contra huésped crónica
El diagnóstico de la EICH crónica se hace sobre la base de características clínicas (por lo menos un signo clínico diagnóstico; por ejemplo, poiquilodermia) o manifestaciones distintivas complementadas por las pruebas pertinentes (por ejemplo, ojo seco con prueba de Schirmer positiva).
Los tejidos que por lo general se ven comprometidos son los de la piel, los ojos, la boca, el cabello, las articulaciones, el hígado y el tubo gastrointestinal. A veces, también hay compromiso de otros tejidos, como los de los pulmones, las uñas, los músculos, el aparato urogenital y el sistema nervioso. En los cuadros 5 a 9 se enumeran las manifestaciones orgánicas de la EICH crónica con una descripción de los hallazgos que son suficientes para establecer el diagnóstico. Es posible que se necesiten biopsias de los sitios afectados para confirmar el diagnóstico.
Las manifestaciones comunes de la piel incluyen alteraciones en su pigmentación, textura, elasticidad y espesor, con pápulas, placas o cambios foliculares. Los síntomas que notifican los pacientes incluyen piel seca, prurito, movilidad limitada, exantemas, escoceduras, o cambios en la coloración o textura. La esclerodermia generalizada a veces conduce a contracturas articulares graves y debilidad. Son comunes la pérdida de cabello y los cambios de las uñas. Otras manifestaciones importantes que se deben evaluar incluyen ojos secos y cambios orales como atrofia, úlceras y liquen plano. Además, se debe registrar si hay contracturas articulares con restricción de la amplitud de movimiento, pérdida de peso, náuseas, dificultad para tragar y diarrea.
| Órgano o sitio | Características diagnósticasb | Características distintivasc | Otras característicasd | Características comunes (observadas en la EICH crónica y en la aguda) |
|---|---|---|---|---|
| aReproducción de Biology of Blood and Marrow Transplantation, Volumen 11 (Número 12), Alexandra H. Filipovich, Daniel Weisdorf, Steven Pavletic, Gerard Socie, John R. Wingard, Stephanie J. Lee, Paul Martin, Jason Chien, Donna Przepiorka, Daniel Couriel, Edward W. Cowen, Patricia Dinndorf, Ann Farrell, Robert Hartzman, Jean Henslee-Downey, David Jacobsohn, George McDonald, Barbara Mittleman, J. Douglas Rizzo, Michael Robinson, Mark Schubert, Kirk Schultz, Howard Shulman, Maria Turner, Georgia Vogelsang, Mary E.D. Flowers, National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: I. Diagnosis and Staging Working Group Report, Páginas 945-956, Derechos de autor 2005, reproducción autorizada por la American Society for Blood and Marrow Transplantation y Elsevier. | ||||
| bSuficientes para establecer el diagnóstico de EICH crónica. | ||||
| cObservadas en la EICH crónica, pero insuficientes por sí mismas para establecer el diagnóstico de EICH crónica. | ||||
| dSe pueden reconocer como parte de la sintomatología de la EICH crónica si se confirma el diagnóstico. | ||||
| eEn todos los casos, se deben excluir infecciones, efectos de los fármacos, neoplasias malignas u otras causas. | ||||
| fPara el diagnóstico de la EICH crónica es necesaria una confirmación por biopsia o radiología (o prueba de Schirmer en los ojos). | ||||
| Cutáneo | Poiquilodermia | Despigmentación | Alteración en la sudoración | Prurito |
| Características similares a liquen plano | Ictiosis | Eritema | ||
| Características escleróticas | Queratosis pilaris | Exantema maculopapular | ||
| Características similares a morfea | Hipopigmentación | |||
| Características similares a liquen escleroso | Hiperpigmentación | |||
| Uñas | Distrofia | |||
| Uñas estriadas, quebradizas o frágiles | ||||
| Onicólisis | ||||
| Pterigion ungueal | ||||
| Caída de las uñas (por lo general, simétrica; suele afectar la mayoría de las uñas)e | ||||
| Cuero cabelludo y vello corporal | Nuevo inicio de alopecia cicatricial o no cicatricial en el cuero cabelludo (después de la recuperación de la quimiorradioterapia) | Debilitamiento del cabello en la cabeza, con áreas irregulares, pelo áspero u opaco (que no se explica por causas endocrinas o de otro tipo) | ||
| Lesiones escamosas o papuloescamosas | Canas prematuras | |||
| Órgano o sitio | Características diagnósticasb | Características distintivasc | Otras característicasd | Características comunes (observadas en la EICH crónica y en la aguda) |
|---|---|---|---|---|
| ALT = alanina-aminotransferasa; AST = aspartato-aminotransferasa; GI = gastrointestinal. | ||||
| a–eConsultar las definiciones en el Cuadro 5. | ||||
| Boca | Características similares a liquen | Xerostomía | Gingivitis | |
| Placas hiperqueratósicas | Mucocele | Mucositis | ||
| Restricción para abrir la boca por la esclerosis | Pseudomembranase | Eritema | ||
| Atrofia de mucosas | Dolor | |||
| Úlcerase | ||||
| Tubo gastrointestinal | Membrana esofágica | Insuficiencia pancreática exocrina | Anorexia | |
| Estrechamiento o estenosis en la parte superior o el tercio medio del esófagoe | Náuseas | |||
| Vómitos | ||||
| Diarrea | ||||
| Pérdida de peso | ||||
| Retraso del crecimiento (lactantes y niños) | ||||
| Bilirrubina total y fosfatasa alcalina >2 veces el límite superior normale | ||||
| ALT o AST >2 veces el límite superior normale | ||||
| Órgano o sitio | Características diagnósticasb | Características distintivasc | Otras característicasd | Características comunes (observadas en la EICH crónica y en la aguda) |
|---|---|---|---|---|
| a–fConsultar las definiciones en el Cuadro 5. | ||||
| Ojos | Nuevo inicio de ojos secos, areniscos o dolorososf | Blefaritis (eritema de los párpados con edema) | ||
| Conjuntivitis cicatricial | ||||
| Queratoconjuntivitis secaf | Fotofobia | |||
| Áreas confluentes de queratopatía punteada | Hiperpigmentación periorbitaria | |||
| Órgano o sitio | Características diagnósticasb | Características distintivasc | Otras característicasd | Características comunes (observadas en la EICH crónica y en la aguda) |
|---|---|---|---|---|
| a–eConsultar las definiciones en el Cuadro 5. | ||||
| Genitales | Características similares a liquen plano | Erosionese | ||
| Cicatrización o estenosis vaginal | Fisurase | |||
| Úlcerase | ||||
| Órgano o sitio | Características diagnósticasb | Características distintivasc | Otras característicasd | Características comunes (observadas en la EICH crónica y en la aguda) |
|---|---|---|---|---|
| AHAI = anemia hemolítica autoinmunitaria; BONO = bronquiolitis obliterante con neumonía organizada; PTI = púrpura trombocitopénica idiopática; PFP = pruebas de funcionamiento pulmonar. | ||||
| a–fConsultar las definiciones en el Cuadro 5. | ||||
| Pulmón | Bronquiolitis obliterante diagnosticada mediante biopsia de pulmón | Bronquiolitis obliterante diagnosticada por PFP y radiologíaf | BONO | |
| Músculos, fascias, articulaciones | Fascitis | Miositis o polimiositisf | Edema | |
| Calambres musculares | ||||
| Artralgia o artritis | ||||
| Hematopoyético e inmunitario | Trombocitopenia | |||
| Eosinofilia | ||||
| Linfopenia | ||||
| Hipo o hipergammaglobulinemia | ||||
| Presencia de autoanticuerpos (AHAI y PTI) | ||||
| Otras | Derrames pericárdicos o pleurales | |||
| Ascitis | ||||
| Neuropatía periférica | ||||
| Síndrome nefrótico | ||||
| Miastenia grave | ||||
| Anomalía en la conducción cardíaca o miocardiopatía | ||||
Factores de riesgo de la enfermedad de injerto contra huésped crónica
La EICH crónica se presenta en alrededor de un 15 % a un 30 % de los niños después de un TCMH de un donante fraterno y en un 20 % a un 45 % de los niños después de un TCMH de un donante no emparentado. El riesgo más alto se relaciona con las células madre de sangre periférica (CMSP), y el riesgo más bajo, con la sangre de cordón umbilical y determinados abordajes de TCMH haploidéntico.
Los factores de riesgo de presentación de EICH crónica son los siguientes:
- Edad del paciente (mayor a 10 años).
- Tipo de donante (donantes no emparentados e incompatibles).
- Uso de CMSP.
- Antecedentes de EICH aguda.
- Régimen de acondicionamiento (regímenes mielosupresores y a base de irradiación corporal total [ICT]).
Varios factores se relacionaron con un aumento del riesgo de mortalidad sin recaída en los niños con EICH crónica grave. Los niños que reciben injertos con incompatibilidad de HLA o que recibieron CMSP, y que en el momento del diagnóstico de la EICH crónica tenían más de 10 años o recuentos plaquetarios inferiores a 100 000/µl presentan un aumento del riesgo de mortalidad sin recaída.
La mortalidad sin recaída fue del 17 % a 1 año, del 22 % a 3 años y del 24 % a 5 años del diagnóstico de la EICH crónica. Muchos de estos niños necesitaron inmunodepresión a largo plazo. Después de 3 años del diagnóstico de la EICH crónica, cerca de un tercio de los niños murieron por causas vinculadas a la mortalidad con recaída o sin recaída, un tercio ya no recibía inmunodepresión y un tercio todavía necesitaban alguna forma de terapia inmunodepresora.
En la bibliografía antigua se describe la EICH crónica como limitada o extensa. En un Consensus Workshop de los Institutos Nacionales de la Salud (NIH) realizado en 2006, se amplió la descripción de la EICH crónica a 3 categorías para predecir mejor los resultados a largo plazo. Las 3 categorías de clasificación por grados de los NIH son las siguientes:
- Enfermedad leve: compromete solo 1 o 2 sitios sin un deterioro funcional importante (puntaje máximo de gravedad de 1 en una escala de 0 a 3).
- Enfermedad moderada: compromete más de 2 sitios (>2) o se relaciona con un puntaje más alto de gravedad (puntaje máximo de 2 en cualquier sitio).
- Enfermedad grave: indica discapacidad importante (puntaje de 3 en cualquier sitio o puntaje de 2 en el pulmón).
Por lo tanto, los pacientes de riesgo alto son aquellos con enfermedad grave en cualquier sitio o compromiso extenso en sitios múltiples, en especial aquellos con las siguientes características:
- Compromiso pulmonar sintomático.
- Compromiso cutáneo mayor del 50 %.
- Recuento plaquetario inferior a 100 000/µl
- Puntaje de desempeño funcional precario (<60 %).
- Pérdida de peso de más del 15 %.
- Diarrea crónica.
- EICH crónica de comienzo progresivo.
- Antecedentes de tratamiento con corticoesteroides de más de 0,5 mg/kg por día para una EICH aguda.
En un estudio se demostró una probabilidad mucho más alta de supervivencia a largo plazo sin EICH y una menor mortalidad relacionada con el tratamiento en los niños que tenían EICH crónica leve y moderada en comparación con los niños que tenían EICH crónica grave. A los 8 años, la probabilidad de continuar con EICH crónica en niños con EICH crónica leve, moderada y grave fue del 4 %, 11 % y 36 %, respectivamente. En otro ensayo prospectivo de gran tamaño con revisión central en el que se usaron los criterios de consenso de los NIH, cerca del 28 % de los pacientes se clasificaron de manera incorrecta con EICH crónica cuando en realidad tenían EICH aguda. Además, se presentaron desafíos importantes cuando se usaron los criterios de consenso de los NIH para la bronquiolitis obliterante en niños.
Tratamiento de la enfermedad de injerto contra huésped crónica
Los corticoesteroides sigue siendo el principal tratamiento de la EICH crónica; sin embargo, se han formulado muchos abordajes para reducir al mínimo la dosis de corticoesteroides, como el uso de inhibidores de la calcineurina. Para los pacientes con enfermedad limitada se prefiere la terapia tópica en las áreas afectadas. Los siguientes fármacos se probaron con cierto éxito:
- Micofenolato mofetilo.
- Pentostatina.
- Sirólimus.
- Rituximab.
- Ibrutinib.
Se evaluaron otros abordajes, incluso fotoaféresis extracorpórea, que muestran cierta eficacia en algunos pacientes.
Las infecciones son la causa principal de muerte relacionada con la EICH crónica, y además afectan en forma importante el funcionamiento orgánico, la calidad de vida y el estado funcional. En consecuencia, todos los pacientes de EICH crónica reciben profilaxis contra la neumonía por Pneumocystis jirovecii, las infecciones por microorganismos encapsulados comunes y la varicela mediante la administración de fármacos como trimetoprim-sulfametoxazol, penicilina y aciclovir.
El 70 % de las muertes de pacientes con EICH crónica se deben a complicaciones relacionadas con el trasplante. Se publicaron directrices para el tratamiento auxiliar y los cuidados médicos de apoyo para pacientes con EICH crónica.
References
- Shlomchik WD, Lee SJ, Couriel D, et al.: Transplantation's greatest challenges: advances in chronic graft-versus-host disease. Biol Blood Marrow Transplant 13 (1 Suppl 1): 2-10, 2007.
- Bolaños-Meade J, Vogelsang GB: Chronic graft-versus-host disease. Curr Pharm Des 14 (20): 1974-86, 2008.
- Filipovich AH, Weisdorf D, Pavletic S, et al.: National Institutes of Health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: I. Diagnosis and staging working group report. Biol Blood Marrow Transplant 11 (12): 945-56, 2005.
- Shulman HM, Kleiner D, Lee SJ, et al.: Histopathologic diagnosis of chronic graft-versus-host disease: National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: II. Pathology Working Group Report. Biol Blood Marrow Transplant 12 (1): 31-47, 2006.
- Zecca M, Prete A, Rondelli R, et al.: Chronic graft-versus-host disease in children: incidence, risk factors, and impact on outcome. Blood 100 (4): 1192-200, 2002.
- Eapen M, Logan BR, Confer DL, et al.: Peripheral blood grafts from unrelated donors are associated with increased acute and chronic graft-versus-host disease without improved survival. Biol Blood Marrow Transplant 13 (12): 1461-8, 2007.
- Eapen M, Rubinstein P, Zhang MJ, et al.: Outcomes of transplantation of unrelated donor umbilical cord blood and bone marrow in children with acute leukaemia: a comparison study. Lancet 369 (9577): 1947-54, 2007.
- Bertaina A, Zecca M, Buldini B, et al.: Unrelated donor vs HLA-haploidentical α/β T-cell- and B-cell-depleted HSCT in children with acute leukemia. Blood 132 (24): 2594-2607, 2018.
- Leung W, Ahn H, Rose SR, et al.: A prospective cohort study of late sequelae of pediatric allogeneic hematopoietic stem cell transplantation. Medicine (Baltimore) 86 (4): 215-24, 2007.
- Arora M, Klein JP, Weisdorf DJ, et al.: Chronic GVHD risk score: a Center for International Blood and Marrow Transplant Research analysis. Blood 117 (24): 6714-20, 2011.
- Jacobsohn DA, Arora M, Klein JP, et al.: Risk factors associated with increased nonrelapse mortality and with poor overall survival in children with chronic graft-versus-host disease. Blood 118 (16): 4472-9, 2011.
- Pavletic SZ, Martin P, Lee SJ, et al.: Measuring therapeutic response in chronic graft-versus-host disease: National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: IV. Response Criteria Working Group report. Biol Blood Marrow Transplant 12 (3): 252-66, 2006.
- Inagaki J, Moritake H, Nishikawa T, et al.: Long-Term Morbidity and Mortality in Children with Chronic Graft-versus-Host Disease Classified by National Institutes of Health Consensus Criteria after Allogeneic Hematopoietic Stem Cell Transplantation. Biol Blood Marrow Transplant 21 (11): 1973-80, 2015.
- Cuvelier GDE, Nemecek ER, Wahlstrom JT, et al.: Benefits and challenges with diagnosing chronic and late acute GVHD in children using the NIH consensus criteria. Blood 134 (3): 304-316, 2019.
- Koc S, Leisenring W, Flowers ME, et al.: Therapy for chronic graft-versus-host disease: a randomized trial comparing cyclosporine plus prednisone versus prednisone alone. Blood 100 (1): 48-51, 2002.
- Couriel D, Carpenter PA, Cutler C, et al.: Ancillary therapy and supportive care of chronic graft-versus-host disease: national institutes of health consensus development project on criteria for clinical trials in chronic Graft-versus-host disease: V. Ancillary Therapy and Supportive Care Working Group Report. Biol Blood Marrow Transplant 12 (4): 375-96, 2006.
- Martin PJ, Storer BE, Rowley SD, et al.: Evaluation of mycophenolate mofetil for initial treatment of chronic graft-versus-host disease. Blood 113 (21): 5074-82, 2009.
- Jacobsohn DA, Gilman AL, Rademaker A, et al.: Evaluation of pentostatin in corticosteroid-refractory chronic graft-versus-host disease in children: a Pediatric Blood and Marrow Transplant Consortium study. Blood 114 (20): 4354-60, 2009.
- Jurado M, Vallejo C, Pérez-Simón JA, et al.: Sirolimus as part of immunosuppressive therapy for refractory chronic graft-versus-host disease. Biol Blood Marrow Transplant 13 (6): 701-6, 2007.
- Cutler C, Miklos D, Kim HT, et al.: Rituximab for steroid-refractory chronic graft-versus-host disease. Blood 108 (2): 756-62, 2006.
- Miklos D, Cutler CS, Arora M, et al.: Ibrutinib for chronic graft-versus-host disease after failure of prior therapy. Blood 130 (21): 2243-2250, 2017.
- González Vicent M, Ramirez M, Sevilla J, et al.: Analysis of clinical outcome and survival in pediatric patients undergoing extracorporeal photopheresis for the treatment of steroid-refractory GVHD. J Pediatr Hematol Oncol 32 (8): 589-93, 2010.
- Carpenter PA, Kitko CL, Elad S, et al.: National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: V. The 2014 Ancillary Therapy and Supportive Care Working Group Report. Biol Blood Marrow Transplant 21 (7): 1167-87, 2015.
Mortalidad tardía posterior a un trasplante de células madre hematopoyéticas
La incidencia más alta de mortalidad después de un TCMH se presenta durante los primeros 2 años, en su mayoría por recaída. En un estudio sobre mortalidad tardía (≥2 años postrasplante) en niños con neoplasias malignas se sometieron a TCMH se observó que alrededor del 20 % de 479 pacientes que estaban vivos a los 2 años murieron posteriormente. La mortalidad tardía en el grupo de trasplante alogénico fue del 15 % (mediana de seguimiento de 10,0 años; intervalo, 2,0–25,6 años), sobre todo por recaída (65 %). Entre los pacientes, el 26 % presentaron muerte tardía después de un TCMH autógeno (mediana de seguimiento, 6,7 años; intervalo, 2,0–22,2 años) y el 88 % de estas muertes se produjo por la recidiva de la neoplasia maligna primaria. La mortalidad no relacionada con las recaídas, la muerte por enfermedad de injerto contra huésped (EICH) crónica y las neoplasias malignas secundarias son menos frecuentes en niños.
En otro estudio se analizaron las causas de la mortalidad tardía después de un segundo trasplante alogénico. De los niños que estaban vivos y sin recaída 1 año después del segundo TCMH, un 55 % estaban vivos a los 10 años. En este grupo, la causa más común de mortalidad entre 1 y 10 años después del trasplante fue la recaída (77 % de las muertes), que en su mayoría, se produjeron en los primeros 3 años después del trasplante. La incidencia acumulada de mortalidad sin recaída en esta cohorte a los 10 años fue del 10 %. La EICH crónica se presentó en el 43 % de los niños de este estudio y fue la causa principal de mortalidad sin recaída.
En un estudio centrado en la mortalidad después de un TCMH autógeno en niños, se observó que las tasas de mortalidad seguían siendo mayores a las de la población general más de 10 años después del procedimiento, pero se acercaron a las tasas de la población general a los 15 años. En el estudio, también se observó una disminución de la mortalidad tardía en las épocas más actuales de tratamiento (antes de 1990, 35,1 %; 1990–1999, 25,6 %; 2000–2010, 21,8 %; P = 0,05).
References
- Schechter T, Pole JD, Darmawikarta D, et al.: Late mortality after hematopoietic SCT for a childhood malignancy. Bone Marrow Transplant 48 (10): 1291-5, 2013.
- Duncan CN, Majhail NS, Brazauskas R, et al.: Long-term survival and late effects among one-year survivors of second allogeneic hematopoietic cell transplantation for relapsed acute leukemia and myelodysplastic syndromes. Biol Blood Marrow Transplant 21 (1): 151-8, 2015.
- Holmqvist AS, Chen Y, Wu J, et al.: Late mortality after autologous blood or marrow transplantation in childhood: a Blood or Marrow Transplant Survivor Study-2 report. Blood 131 (24): 2720-2729, 2018.
Efectos tardíos del trasplante de células madre hematopoyéticas en niños
En los datos provenientes de estudios de adultos y niños sobrevivientes de TCMH se ha observado un efecto importante de las exposiciones relacionadas con el tratamiento en la supervivencia y la calidad de vida. En un estudio de pacientes que estaban con vida 2 años después de someterse a TCMH, los sobrevivientes presentaron un aumento del riesgo de muerte prematura 9,9 veces mayor al de los controles ajustados por edad y sexo de la población general de los Estados Unidos. En otro estudio multicéntrico se demostró que más de la mitad de los supervivientes adultos que se sometieron a un TCMH durante la infancia tenían un problema de salud crónico de grado 3 o 4. Los sobrevivientes tenían una oportunidad relativa (OR) de 15,1 en comparación con sus hermanos.
Desafíos metodológicos de los estudios sobre efectos tardíos del trasplante de células madre hematopoyéticas
Si bien la causa principal de muerte de los pacientes que se someten a TCMH es la recaída de la enfermedad primaria, un número importante de estos pacientes mueren por infecciones relacionadas con la enfermedad de injerto contra huésped (EICH), segundas neoplasias malignas, o complicaciones cardíacas o pulmonares. Además, en otros estudios se reveló que hasta el 40 % de los sobrevivientes de TCMH presentan efectos graves, incapacitantes o potencialmente mortales, o mueren debido a un efecto adverso relacionado con el tratamiento de un cáncer primario nuevo o previo.
Antes de iniciar estudios dirigidos a la reducción de la incidencia y gravedad de estos efectos, es importante entender qué conduce a la presentación de estas complicaciones.
- Tratamiento anterior al trasplante: si bien el tratamiento anterior al trasplante tiene una función importante, en muchos estudios no se incluyen detalles de las exposiciones significativas vinculadas con el tratamiento anterior al TCMH.
- Régimen preparatorio: el régimen preparatorio de trasplante en sí mismo (es decir, irradiación corporal total [ICT] y dosis altas de quimioterapia) se ha estudiado con frecuencia, pero este tratamiento intensivo es solo una pequeña parte de un ciclo terapéutico prolongado lleno de causas presuntas de efectos tardíos.
- Alogenicidad: el efecto de la alogenicidad (diferencias en los antígenos de HLA mayores y menores que conducen a la EICH, autoinmunidad, inflamación crónica y, algunas veces, a daños orgánicos indetectables) también contribuye a estos efectos tardíos.
- Exposición prolongada a fármacos no quimioterapéuticos: los pacientes sometidos a trasplante quizás reciban inmunodepresores con toxicidad significativa durante un periodo largo de tiempo (por ejemplo, ciclosporina o tacrólimus, que pueden causar hipertensión y afectación renal). Además, es común que los pacientes reciban medicamentos de apoyo o antimicrobianos durante ciclos largos, lo que en ocasiones se relaciona con daño orgánico (por ejemplo, amfotericina B liposomal). Se debe tener en cuenta estos medicamentos cuando se evalúe el riesgo de efectos tardíos.
Hay diferencias individuales en la susceptibilidad al daño de un órgano específico a causa de la quimioterapia o al riesgo de presentar EICH de acuerdo con las diferencias genéticas tanto del donante como del receptor.
Efectos tardíos en el sistema cardiovascular
Si bien la disfunción cardíaca se ha estudiado de forma extensa en entornos diferentes al TCMH, es menos lo que se conoce sobre la incidencia y los factores pronósticos de una insuficiencia cardíaca congestiva posterior a un TCMH en la niñez. A continuación se describen las exposiciones posiblemente cardiotóxicas que son exclusivas del TCMH:
- Acondicionamiento con dosis altas de quimioterapia, en particular, ciclofosfamida.
- Irradiación corporal total.
Los sobrevivientes de TCMH tienen un aumento de riesgo de presentar factores de riesgo cardiovascular como hipertensión y diabetes, debido en parte a la exposición a la ICT y a la terapia inmunodepresora prolongada luego de un TCMH alogénico, o a la relación con otras afecciones (por ejemplo, hipotiroidismo o deficiencia de la hormona del crecimiento). En un estudio de 661 pacientes pediátricos que sobrevivieron por lo menos 2 años después de un TCMH alogénico, el 52 % de los pacientes tenían obesidad o sobrepeso en su examen más reciente, el 18 % presentaban dislipidemia (relacionada con la administración de antraciclina o con la irradiación craneal o torácica anterior al TCMH) y el 7 % de los pacientes recibieron un diagnóstico de diabetes.
Se analizaron las tasas de desenlaces cardiovasculares entre casi 1500 sobrevivientes de trasplantes (supervivencia ≥2 años) tratados en Seattle de 1985 a 2006. Las comparaciones entre los grupos de sobrevivientes y poblacionales se emparejaron por edad, año y sexo. Los sobrevivientes presentaron aumento en las tasas de muerte cardiovascular (diferencia en la tasa de incidencia ajustada, 3,6 por 1000 personas-año [intervalo de confianza 95 %, 1,7–5,5]). También presentaron un aumento en la incidencia acumulada de las siguientes afecciones:
- Cardiopatía isquémica.
- Miocardiopatía e insuficiencia cardíaca.
- Accidente cerebrovascular.
- Enfermedades vasculares.
- Trastornos del ritmo cardíaco.
Los sobrevivientes también presentaron un incremento de la incidencia acumulada de afecciones relacionadas que aumentaron el riesgo de enfermedades cardiovasculares más graves (es decir, hipertensión, enfermedad renal, dislipidemia y diabetes).
Además, el funcionamiento cardíaco y las exposiciones a la quimioterapia y la radioterapia previas al TCMH mostraron tener un efecto importante en el funcionamiento cardíaco luego del TCMH. Al evaluar a los pacientes después de un TCMH por efectos a largo plazo, es importante considerar los niveles de exposición a las antraciclinas y de irradiación dirigida al tórax previos al TCMH. Si bien es necesario realizar estudios más específicos a fin de verificar esto, la evidencia científica actual indica que el riesgo de complicaciones cardiovasculares tardías luego de un TCMH se debe en gran parte a las exposiciones terapéuticas previas al trasplante, con muy poco riesgo adicional por las exposiciones relacionadas con el acondicionamiento o la EICH.
Para obtener más información, consultar la sección Efectos tardíos en el sistema cardiovascular en Efectos tardíos del tratamiento anticanceroso en la niñez.
Efectos tardíos neurocognitivos
La mayoría de estudios dan cuenta de un desarrollo neurológico normal luego de un TCMH, sin indicios de deterioro.
Los investigadores del St. Jude Children’s Research Hospital presentaron un informe sobre la cohorte longitudinal más grande hasta la fecha, en el que describen una excelente estabilidad del funcionamiento cognitivo global y el rendimiento académico durante 5 años de seguimiento postrasplante. Este grupo de trabajo notificó desenlaces más precarios en pacientes que se sometieron a trasplante de donante no emparentado cuando los pacientes recibieron ICT y cuando presentaron EICH. Pero estos efectos en los desenlaces fueron pequeños comparados con los efectos mucho más importantes que tuvo el estado socioeconómico sobre el funcionamiento cognitivo. En la mayor parte de los estudios publicados se notifican desenlaces similares. En una cohorte de 47 pacientes a los que se les dio seguimiento durante 2 años después del TCMH, se notificaron funcionamientos cognitivos y logros académicos normales. En una cohorte numerosa a la que se dio seguimiento desde antes del trasplante hasta 2 años después del TCMH, también se observó un funcionamiento cognitivo estable. En un estudio más pequeño, se notificó un funcionamiento normal similar y ausencia de deterioro con el paso del tiempo en sobrevivientes de TCMH. Los sobrevivientes de TCMH no difirieron de sus hermanos en cuanto al funcionamiento cognitivo y académico, con la excepción de que los sobrevivientes se desempeñaron mejor que sus hermanos en las mediciones de organización perceptual. De acuerdo a los hallazgos hasta la fecha, el TCMH acarrearía un riesgo de bajo a mínimo de deficiencias cognitivas y académicas tardías en los sobrevivientes.
Sin embargo, en algunos estudios se notificó cierto deterioro en el funcionamiento cognitivo después de un TCHM. En estos estudios, se tendió a incluir muestras con un porcentaje alto de niños muy pequeños. En un estudio, se notificó un declive importante del coeficiente intelectual (CI) de la cohorte a 1 año del TCMH; estas deficiencias se mantuvieron 3 años después del trasplante. De forma similar, en estudios realizados en Suecia se observaron deficiencias en los dominios visuoespacial y de funcionamiento ejecutivo en niños muy pequeños que se sometieron a trasplante con ICT. En otro estudio del St. Jude Children's Research Hospital, se notificó que, si bien todos los niños menores de 3 años presentaron una disminución del CI 1 año después del trasplante, los pacientes que no recibieron ICT durante el acondicionamiento se recuperaron más tarde. Los pacientes sometidos a ICT exhibieron un CI significativamente más bajo a los 5 años (P = 0,05) que quienes no recibieron este tipo de irradiación.
Para obtener más información, consultar la sección Trasplante de células madre hematopoyéticas en Efectos tardíos del tratamiento anticanceroso en la niñez.
Efectos tardíos en el aparato digestivo
Disfunción gastrointestinal, biliar y pancreática
La mayoría de los efectos gastrointestinales se relacionan con la EICH aguda prolongada y la EICH crónica (consultar el Cuadro 10). Para obtener más información, consultar la sección Hepatobiliares en Efectos tardíos del tratamiento anticanceroso en la niñez.
A medida que se controla la EICH y se desarrolla tolerancia, la mayoría de los síntomas desaparecen. Las preocupaciones hepatobiliares principales se refieren a las consecuencias de la hepatitis vírica adquirida antes del trasplante o durante este, la litiasis biliar y las lesiones hepáticas focales. Se deberán realizar pruebas serológicas víricas y de reacción en cadena de la polimerasa para diferenciar estas complicaciones, de la EICH que se presenta con lesión hepatocelular.
| Áreas problemáticas | Causas comunes | Causas menos comunes |
|---|---|---|
| ALT = alanina–transaminasa; FA = fosfatasa alcalina; CMV = citomegalovirus; γ-GT = γ‑glutamiltranspeptidasa; Mg; EICH = enfermedad de injerto contra huésped++ = magnesio; VHS = virus del herpes simple; VVZ = virus de la varicela zóster. | ||
| aReproducción de Biology of Blood and Marrow Transplantation, Volumen 17 (Número 11), Michael L. Nieder, George B. McDonald, Aiko Kida, Sangeeta Hingorani, Saro H. Armenian, Kenneth R. Cooke, Michael A. Pulsipher , K. Scott Baker, National Cancer Institute–National Heart, Lung and Blood Institute/Pediatric Blood and Marrow Transplant Consortium First International Consensus Conference on Late Effects After Pediatric Hematopoietic Cell Transplantation: Long-Term Organ Damage and Dysfunction, Páginas 1573–1584, Derechos de autor 2011, reproducción autorizada por la American Society for Blood and Marrow Transplantation y Elsevier. | ||
| Síntomas esofágicos: pirosis, disfagia, odinofagia | EICH oral crónica (cambios en la mucosa, dentición precaria, xerostomía) | EICH crónica esofágica (membranas, anillos, fibrosis submucosa y estenosis, aperistaltismo) |
| Reflujo de líquido gástrico | Dismotilidad hipofaríngea (miastenia grave, incoordinación cricofaríngea) | |
| Escamoso > adenocarcinoma | ||
| Esofagitis farmacógena | ||
| Infecciones (fúngica, vírica) | ||
| Síntomas del tubo digestivo superior: anorexia, náuseas, vómitos | EICH gastrointestinal aguda prolongada | Insuficiencia suprarrenal secundaria |
| Activación de infección latente (CMV, VHS, VVZ) | Contagio de infección (virus intestinales, giardia, criptosporidios, Haemophilus pylori) | |
| Efectos adversos farmacológicos | Dismotilidad intestinal | |
| Síntomas en el intestino delgado y el colon: diarrea y dolor abdominal | EICH gastrointestinal aguda prolongada | Contagio de infección (virus, bacterias, parásitos intestinales) |
| Activación de CMV y VVZ latentes | Insuficiencia pancreática | |
| Medicamentos (micofenolato mofetilo, Mg++, antibióticos) | colitis por Clostridium difficile colitis | |
| Colitis colágena (EICH) | ||
| Pocos frecuentes: enteropatía inflamatoria, esprúe; hipoabsorción de sales biliares; hipoabsorción de disacáridos | ||
| Alteraciones hepáticas | EICH colestásica | EICH hepatítica |
| Hepatitis viral crónica (B y C) | Hepatitis por VVZ o VHS | |
| Cirrosis | Absceso fúngico | |
| Hiperplasia nodular focal | Hiperplasia nodular regenerativa | |
| Aumento inespecífico de enzimas hepáticas en el suero (FA, ALT, γ-GT) | Obstrucción biliar | |
| Lesión hepática farmacógena | ||
| Alteraciones biliares y pancreáticas | Colecistitis | Atrofia o insuficiencia pancreática |
| Cálculos o sedimento biliar en el conducto colédoco | Pancreatitis o edema por cálculos o sedimento biliar | |
| Sedimento en la vesícula biliar (bilirrubinato de calcio) | Pancreatitis relacionada con el tacrólimus | |
| Cálculos biliares | ||
Sobrecarga de hierro
La sobrecarga de hierro se presenta en casi todos los pacientes que se someten a un TCMH; en particular, si el procedimiento se realiza por una afección relacionada con la dependencia a las transfusiones antes de un TCMH (por ejemplo, talasemia, síndromes de fracaso de médula ósea) o tratamientos previos al TCMH que requieren transfusiones luego de una quimioterapia mielotóxica (por ejemplo, leucemias agudas). Las afecciones inflamatorias, como la EICH, también aumentan la absorción gastrointestinal de hierro. Es posible que las afecciones no relacionadas con un TCMH que conducen a sobrecarga de hierro produzcan disfunción cardíaca, trastornos endocrinos (por ejemplo, insuficiencia hipofisaria, hipotiroidismo), diabetes, efectos neurocognitivos y segundas neoplasias malignas.
No se han estudiado bien los efectos de la sobrecarga de hierro en la morbilidad posterior a un TCMH; sin embargo, cuando se reducen las concentraciones de hierro luego de un TCMH por talasemia se observa una mejora del funcionamiento cardíaco.
Aunque los datos que sustentan las terapias de reducción de hierro, como las flebotomías o la quelación luego de un TCMH, no han permitido identificar las concentraciones específicas en las que se debería llevar a cabo la reducción de hierro, las concentraciones altas de ferritina o las pruebas de una sobrecarga considerable de hierro obtenidas mediante biopsia del hígado o imágenes por resonancia magnética (IRM) ponderadas en T2 se deben abordar mediante una terapia de reducción de hierro.
Efectos tardíos en el sistema endocrino
Disfunción tiroidea
En los estudios se observa que las tasas de disfunción tiroidea en niños luego de un TCMH mielosupresor no son uniformes, pero en series más grandes se notifica un promedio de incidencia de alrededor del 30 %. Una incidencia más baja en adultos (15 % en promedio) y un aumento importante de la incidencia en niños menores de 10 años que recibieron un TCMH indican que es posible que una glándula tiroidea en desarrollo sea más susceptible al daño.
La radiación local dirigida a la tiroides antes del trasplante contribuye a tasas altas de disfunción tiroidea en pacientes con linfoma de Hodgkin. En estudios iniciales, se observaron tasas muy elevadas de disfunción tiroidea después de fracciones altas de dosis únicas de ICT; sin embargo, la combinación de ICT fraccionada tradicional y ciclofosfamida en comparación con la combinación de busulfano y ciclofosfamida exhibió tasas similares de disfunción tiroidea, lo que indica el efecto dañino para la tiroides de las dosis altas de quimioterapia. Se destaca que en un estudio numeroso se observó que los pacientes tratados con ICT o busulfano tuvieron tasas altas de disfunción tiroidea similares, mientras que los pacientes que recibieron treosulfano o regímenes a base de quimioterapia de intensidad reducida tuvieron tasas bajas de enfermedad tiroidea. Para obtener más información, consultar la sección Disfunción tiroidea posterior a un trasplante en Efectos tardíos del tratamiento anticanceroso en la niñez.
Se presentan tasas más altas de disfunción tiroidea con la profilaxis monomedicamentosa que con la profilaxis de 3 medicamentos para la EICH. Se observan tasas más altas de disfunción tiroidea luego de un TCMH de donante no emparentado que luego de un TCMH de donante emparentado (36 vs. 9 %), lo que indica que el daño aloinmunitario causa disfunción tiroidea.
Retraso del crecimiento
El retraso del crecimiento es por lo general multifactorial. Los factores que desempeñan una función en el fracaso de los niños pequeños sometidos a un TCMH para alcanzar la altura esperada como adultos son los siguientes:
- Disminución en la concentración de la hormona del crecimiento.
- Disfunción tiroidea.
- Alteración de la producción de hormonas sexuales en la pubertad.
- Terapia con corticoesteroides.
- Estado nutricional precario.
La incidencia de retraso del crecimiento varía del 20 % al 80 % según la edad, los factores de riesgo y la definición de retraso del crecimiento que emplean los grupos en sus informes. Los factores de riesgo son los siguientes:
- Irradiación corporal total.
- Irradiación craneal.
- Edad más joven.
- TCMH por una leucemia linfoblástica aguda.
- TCMH durante un periodo de crecimiento rápido en la pubertad.
Los pacientes menores de 10 años en el momento de un TCMH tienen el mayor riesgo de retraso del crecimiento, pero también responden mejor a la terapia de reemplazo hormonal. Los exámenes de detección tempranos y la derivación de pacientes con signos de retraso del crecimiento a un especialista en endocrinología pueden producir una importante restauración de la altura en los niños más pequeños.
Para obtener más información, consultar la sección Deficiencia de la hormona del crecimiento en Efectos tardíos del tratamiento anticanceroso en la niñez.
Composición corporal anómala y síndrome metabólico
Después de un TCMH, los adultos sobrevivientes tienen un riesgo 2,3 veces mayor de muerte prematura relacionada con causas cardiovasculares que la población general. Se desconoce en su mayor parte la causa exacta del riesgo cardiovascular y la muerte subsiguiente, aunque se ha indicado que una consecuencia del TCMH es el síndrome metabólico (una constelación de obesidad central, resistencia a la insulina, intolerancia a la glucosa, dislipidemia e hipertensión), sobre todo resistencia a la insulina.
En estudios en los que se compararon sobrevivientes de leucemia sometidos a tratamiento convencional con aquellos sometidos a TCMH, se encontró que los sobrevivientes de trasplante tienen significativamente más probabilidades de manifestar síndrome metabólico o múltiples factores adversos de riesgo cardíaco, como adiposidad central, hipertensión, resistencia a la insulina y dislipidemia. La preocupación es que, con el tiempo, los sobrevivientes que presentan síndrome metabólico luego de un TCMH tendrán un riesgo más alto de episodios cardiovasculares importantes o muerte prematura por causas relacionadas con enfermedades cardiovasculares.
Para obtener más información, consultar la sección Síndrome metabólico en Efectos tardíos del tratamiento anticanceroso en la niñez.
Obesidad sarcopénica
La relación de la obesidad con la diabetes y el riesgo cardiovascular en la población general está bien establecida, pero la obesidad, según lo determina el índice de masa corporal (IMC), no es común en los sobrevivientes a largo plazo después de un TCMH. Sin embargo, a pesar de tener un IMC normal, los sobrevivientes de TCMH presentan una composición corporal sumamente alterada que conduce a un aumento del porcentaje de masa adiposa y una reducción de la masa corporal magra. Este hallazgo, que se denomina obesidad sarcopénica. ocasiona una pérdida de los receptores de insulina de los miocitos y un aumento de los receptores de insulina de los adipocitos; este último es menos eficaz para ligar la insulina y eliminar la glucosa, lo que a la larga contribuye a la resistencia a la insulina.
Los datos preliminares de 119 niños y adultos jóvenes sobrevivientes, y 81 hermanos sanos que participaron como grupo de control permiten indicar que los sobrevivientes de TCMH tenían un peso significativamente más bajo, pero sin diferencias en el IMC o la circunferencia de la cintura cuando se los comparó con los hermanos. Los sobrevivientes de TCMH tuvieron un porcentaje de tejido adiposo significativamente más alto y una masa magra más baja que los controles. Los sobrevivientes de TCMH presentaron una resistencia a la insulina significativamente mayor y también una incidencia más alta de otros factores de riesgo cardiovascular, como la elevación del colesterol total, el colesterol de las lipoproteínas de baja densidad y los triglicéridos. Estas diferencias solo se establecieron en pacientes que recibieron ICT como parte del régimen de acondicionamiento para el trasplante.
Efectos tardíos en el sistema osteomuscular
Densidad mineral ósea baja
En un número limitado de estudios se abordó la densidad mineral ósea baja posterior al TCMH en niños. Una proporción importante de niños presentaron una reducción de la densidad mineral ósea de todo el cuerpo o puntajes lumbares Z que mostraban osteopenia (18–33 %) u osteoporosis (6–21 %). Aunque se describieron factores de riesgos generales (sexo femenino, inactividad física, estado nutricional precario, etnia blanca o asiática, antecedentes familiares, ICT, irradiación craneoespinal, terapia con corticoesteroides, EICH, terapia con ciclosporina y deficiencias endocrinas [por ejemplo, deficiencia de la hormona del crecimiento, hipogonadismo]), la mayoría de las poblaciones de los estudios fueron demasiado pequeñas para llevar a cabo un análisis multivariante que probara la importancia relativa de cada uno de estos factores.
En algunos estudios con adultos se observó una mejora de la densidad mineral ósea después de un TCMH con el transcurso del tiempo; sin embargo, esto todavía no se ha establecido en los niños.
El tratamiento en pediatría por lo general abarca un abordaje multifactorial, con complementos de vitamina D y calcio, reducción al mínimo de la terapia con corticoesteroides, ejercicios con pesas y resolución de otros problemas endocrinos. La función de la terapia con bisfosfonatos en niños con esta afección no resulta clara.
Para obtener más información, consultar la sección Osteoporosis y fracturas en Efectos tardíos del tratamiento anticanceroso en la niñez.
Osteonecrosis
La incidencia notificada de osteonecrosis en los niños luego de un TCMH fue del 1 % al 14 %; sin embargo estos estudios fueron retrospectivos y subestimaron la incidencia real, porque los pacientes quizá hayan sido asintomáticos al inicio del ciclo de la enfermedad. En 2 estudios prospectivos se observó una incidencia del 30 % al 44 % mediante exámenes de detección rutinarios con IRM de las posibles articulaciones afectadas. La osteonecrosis por lo general se presenta en un lapso de 3 años luego de un TCMH, con una mediana de aparición cercana a 1 año. Las localizaciones más comunes son las rodillas (30–40 %), las caderas (19–24 %) y los hombros (9 %). La mayoría de los pacientes experimentan osteonecrosis en 2 o más articulaciones.
En un informe prospectivo, los factores de riesgo evaluados por análisis multivariante incluyeron edad (con marcado aumento en los niños mayores de 10 años; OR, 7,4) y presencia de osteonecrosis en el momento del trasplante. Es importante señalar que los factores previos al TCMH, como la exposición a corticoesteroides, son muy importantes para determinar el riesgo del paciente. En este estudio, 14 de 44 niños que presentaron osteonecrosis tenían la enfermedad antes del TCMH. En un estudio retrospectivo de casos y controles anidados con 160 casos y 478 niños de control realizado por el Center for International Blood and Marrow Transplant Research (CIBMTR), se indicó que los factores de riesgo de osteonecrosis eran una edad mayor (>5 años), el sexo femenino y la EICH crónica.
Por lo general, el tratamiento consistió en la reducción al mínimo de la terapia con corticoesteroides y el reemplazo quirúrgico de la articulación. La mayoría de los pacientes no reciben el diagnóstico hasta que presentan síntomas. En un estudio de 44 pacientes con lesiones de osteonecrosis a los que se les practicó un examen rutinario anual con IRM, 4 pacientes presentaron una resolución completa y 2 presentaron resolución en una de las múltiples articulaciones afectadas. Debido a la observación de que algunas lesiones pueden sanar con el tiempo se indica prudencia en el tratamiento quirúrgico de lesiones asintomáticas.
Para obtener más información, consultar la sección Osteonecrosis en Efectos tardíos del tratamiento anticanceroso en la niñez.
Efectos tardíos en el aparato reproductor
Desarrollo puberal
Con frecuencia se presenta retraso, ausencia o falta de desarrollo puberal luego de un TCMH. En 2 estudios se observó retraso o insuficiencia puberal en el 16 % de las niñas que recibieron ciclofosfamida sola, en el 72 % de quienes recibieron busulfano con ciclofosfamida y en el 57 % de quienes se sometieron a ICT fraccionada. En los varones se notó desarrollo puberal incompleto o insuficiencia puberal en el 14 % de los que recibieron ciclofosfamida sola, en el 48 % de los que recibieron busulfano con ciclofosfamida y en el 58 % de los que se sometieron a ICT. Los varones que recibieron más de 24 Gy de radiación dirigida a los testículos presentaron azoospermia e insuficiencia en la producción de testosterona, lo que motivó la administración de complementos para desarrollar las características sexuales secundarias.
Fertilidad
Mujeres
La exposición a la ciclofosfamida antes y después del trasplante es el factor que afecta la fertilidad que mejor se ha estudiado. Las mujeres pospúberes menores de 30 años pueden tolerar hasta 20 g/m2 de ciclofosfamida y conservar la función ovárica; las mujeres prepúberes pueden tolerar un máximo de 25 g/m2 a 30 g/m2. Aunque los otros efectos que añaden las exposiciones pretrasplante a la ciclofosfamida y otros fármacos no se cuantificaron de modo específico en los estudios, estas exposiciones además de la quimioterapia y la radioterapia relacionadas con el trasplante conducen a insuficiencia ovárica en el 65 % al 84 % de las mujeres sometidas a TCMH mielosupresor. El uso de ciclofosfamida, busulfano e ICT como parte del régimen preparatorio se relaciona con un funcionamiento ovárico más precario. La edad más temprana en el momento del TCMH se relaciona con una mayor probabilidad de menarquia y ovulación. Para obtener más información, consultar la sección Funcionamiento ovárico posterior a un trasplante de células madre hematopoyéticas en Efectos tardíos del tratamiento anticanceroso en la niñez.
Los estudios de embarazos constituyen un reto porque raras veces los datos indican si las personas están tratando de tener hijos. De todos modos, en un estudio grande sobre embarazo en sobrevivientes de todas las edades de trasplante mielosupresor se demostró la fecundación en 32 de 708 pacientes (4,5 %). Entre las mujeres que intentaron procrear, las pacientes expuestas a ciclofosfamida sola (dosis total de 6,7 g/m2 sin exposición pretrasplante) tuvieron la mayor probabilidad de embarazo (56 de 103, 54 %), mientras que aquellas que recibieron busulfano con ciclofosfamida mielosupresora (0 de 73, 0 %) o ICT (7 de 532, 1,3 %) tuvieron tasas de embarazo mucho más bajas.
Hombres
La capacidad de los hombres de producir espermatozoides funcionales disminuye con la exposición a dosis más altas y de ciertos tipos de quimioterapia. La mayoría de los hombres se volverán azoospérmicos al recibir una dosis de ciclofosfamida de 300 mg/kg. Luego de un TCMH, el 48 % al 85 % de los hombres presentarán insuficiencia gonadal. En un estudio, se observó que los hombres que recibieron ciclofosfamida fecundaron solo el 24 % de las veces en comparación con el 6,5 % en los hombres que recibieron busulfano y ciclofosfamida y el 1,3 % en aquellos sometidos a ICT. Para obtener más información, consultar la sección Funcionamiento testicular posterior a un trasplante de células madre hematopoyéticas en Efectos tardíos del tratamiento anticanceroso en la niñez.
Efecto de los regímenes no mielosupresores de toxicidad e intensidad reducidas
A partir de evidencia clara sobre el efecto de la dosis y la disminución de la gonadotoxicidad de algunos regímenes quimioterapéuticos de toxicidad reducida, es factible que el uso de los regímenes no mielosupresores de intensidad y toxicidad reducidas conduzcan a una mayor probabilidad de conservar la capacidad reproductiva luego de un TCMH. Dado que el uso de estos regímenes es relativamente nuevo y la mayoría se limita a pacientes mayores o más enfermos, la mayoría de los informes se refieren a casos únicos. Los informes de registros están empezando a referirse a los embarazos posteriores a estos procedimientos. Además, en un estudio de un solo centro, se comparó la administración de busulfano y ciclofosfamida mielosupresores con fludarabina y melfalán de intensidad reducida.[Nivel de evidencia C1] Se presentó pubertad espontánea en el 56 % de las niñas y en el 89 % de los niños después de la administración de busulfano y ciclofosfamida, mientras que el 90 % de las niñas y todos los niños del grupo de fludarabina y melfalán entraron de modo espontáneo en la pubertad (P = 0,012). El número de niñas (61 %) que recibieron acondicionamiento con busulfano y ciclofosfamida y necesitaron reemplazo hormonal fue significativamente más alto que el número de niñas que necesitó reemplazo hormonal en el grupo de fludarabina y melfalán (10,5 %; P = 0,012). En los niños, no se observaron diferencias entre los 2 grupos de acondicionamiento en el momento del aumento de la hormona folículo estimulante (FSH) (mediana de 4 años en el grupo de fludarabina y melfalán vs. 6 años en el grupo de busulfano y ciclofosfamida). Mientras que los 2 regímenes tienen efectos similares en el testículo, parece que el funcionamiento ovárico se conserva mejor en las niñas sometidas a TCMH con abordajes de acondicionamiento de intensidad reducida.
En un segundo estudio se compararon las concentraciones séricas de hormona antimuleriana (AMH) e inhibina B en 121 niños que sobrevivieron más de 1 año después de un solo TCMH y recibieron un régimen a base de treosulfano (treosulfano, baja toxicidad), un régimen de fludarabina y melfalán (Flu/Mel; intensidad reducida), o un régimen de busulfano y ciclofosfamida (Bu/Cy; mielosupresor). La media de edad en el momento del TCMH fue 3,6 años; la media de edad en el momento del seguimiento fue 11,8 años. La media de seguimiento fue de 9,9 años. La media de los puntajes de desviación estándar (PDE) de la AMH fueron significativamente más alta después del treosulfano (-1,047) y de Flu/Mel (-1,255) que después de Bu/Cy (-1,543), lo que indica menos deterioro de la reserva ovárica con treosulfano y Flu/Mel que con Bu/Cy. La media de la concentración sérica de AMH fue significativa mejor con el treosulfano (>1,0 μg/l) que con Flu/Mel o Bu/Cy. En los varones, la media de los PDE de inhibina B fue significativamente más alta después del treosulfano (-0,506) que después de Flu/Mel (-2,53) o ciertos regímenes Bu/Cy (-1,23). Los autores llegaron a la conclusión de que los regímenes a base de treosulfano quizás confieran un panorama más favorecedor para la reserva gonadal en ambos sexos que los regímenes Flu/Mel or Bu/Cy.
En un tercer estudio se compararon los marcadores de la función gonadal tras el acondicionamiento mieloablativo con regímenes Bu/Cy y ciclofosfamida/ICT con un régimen de acondicionamiento de intensidad reducida con fludarabina, melfalán y alemtuzumab.
- Las pacientes que recibieron acondicionamiento de intensidad reducida tuvieron menos probabilidad de presentar insuficiencia ovárica primaria, como lo demostró el aumento de la FSH (P = 0,02) y la baja concentración de estradiol (P = 0,01) o la elevación de la hormona luteinizante (P = 0,09).
- La mayoría de las mujeres de los grupos de acondicionamiento de intensidad reducida (75 %) y acondicionamiento mieloablativo (93 %) tenían concentraciones bajas de AMH, lo que indicó una reserva ovárica baja o inexistente.
- En los hombres, aunque las concentraciones medianas de inhibina B fueron superiores tras el acondicionamiento de intensidad reducida, no fueron significativamente diferentes entre los 2 grupos. De los 11 varones que recibieron acondicionamiento de intensidad reducida (91 %), 10 presentaron azoospermia u oligospermia, al igual que los 10 varones que recibieron acondicionamiento mieloablativo (100 %). La mediana de tiempo transcurrido desde el TCMH hasta el análisis del semen fue de 3,7 años (intervalo, 1,3–12,2 años).
- Muchos de estos pacientes habían tenido exposición, antes del TCMH, a fármacos gonadotóxicos que no se tuvieron en cuenta en el análisis.
- Aunque este estudio fue pequeño, aportó pruebas de que el riesgo de infertilidad tras regímenes de acondicionamiento de intensidad reducida como el de fludarabina, melfalán y alemtuzumab tal vez sea importante.
Efectos tardíos en el aparato respiratorio
Disfunción pulmonar crónica
Después de un TCMH se observan las 2 formas siguientes de disfunción pulmonar crónica:
- Enfermedad pulmonar obstructiva.
- Enfermedad pulmonar restrictiva.
La incidencia de ambas formas de toxicidad pulmonar oscila entre el 10 % y el 40 % según la fuente donante, el intervalo de tiempo luego de un TCMH, la definición que se usó y la presencia de EICH crónica. En ambas afecciones se cree que el depósito de colágeno y la formación de fibrosis, ya sea en el espacio intersticial (enfermedad pulmonar restrictiva) o el espacio peribronquiolar (enfermedad pulmonar obstructiva), son hallazgos patológicos subyacentes.
Enfermedad pulmonar obstructiva
La forma más común de enfermedad pulmonar obstructiva después de un TCMH alogénico es la bronquiolitis obliterante. Esta afección es un proceso inflamatorio que produce obliteración bronquiolar, fibrosis y enfermedad pulmonar obstructiva progresiva.
Tradicionalmente, el término bronquiolitis obliterante se usó para describir la EICH crónica de pulmón que comienza entre 6 y 20 meses después de un TCMH. Las pruebas del funcionamiento pulmonar indican una enfermedad pulmonar obstructiva con preservación general de la capacidad vital forzada (CVF), reducción del volumen espiratorio forzado en un segundo (VEF1), y disminuciones relacionadas en el cociente VEF1/CVF, con disminución importante de la capacidad de difusión pulmonar del monóxido de carbono (DLCO) o sin esta.
Los factores de riesgo de la bronquiolitis obliterante son los siguientes:
- Valores más bajos de VEF1/CVF antes del trasplante.
- Infecciones pulmonares simultáneas.
- Aspiración crónica.
- EICH aguda y crónica.
- Mayor edad del receptor.
- Uso de donantes incompatibles.
- Acondicionamiento con dosis altas (vs. intensidad reducida).
La evolución clínica de la bronquiolitis obliterante es variable, pero los pacientes con frecuencia presentan insuficiencia respiratoria progresiva y debilitante a pesar del inicio de una mejor inmunodepresión.
El tratamiento estándar de la enfermedad pulmonar obstructiva combina la inmunodepresión mejorada con cuidados médicos de apoyo que incluyen profilaxis antimicrobiana, terapia broncodilatadora y oxígeno complementario, cuando se indica. La presunta función del factor de necrosis tumoral α en la patogenia de la enfermedad pulmonar obstructiva, indica que el empleo de fármacos neutralizantes como el etanercept quizá sea prometedor.
Enfermedad pulmonar restrictiva
La enfermedad pulmonar restrictiva se define por reducciones de la CVF, la capacidad pulmonar total (CPT) y la DLCO. Al contrario de la enfermedad pulmonar obstructiva, el cociente VEF1/CVF se mantiene cercano al 100 %. La enfermedad pulmonar restrictiva es común luego de un TCMH y se notificó en el 25 % al 45 % de los pacientes en el día 100. Es importante notar que las disminuciones de la CPT o la CVF que se presentan a los 100 días y al año del TCMH se relacionan con un aumento en la mortalidad sin recaída. En informes iniciales se indicó que la incidencia de enfermedad pulmonar restrictiva aumenta con la edad del receptor, pero estudios posteriores revelaron enfermedades pulmonares restrictivas importantes en niños que reciben un TCMH.
La forma más reconocible de enfermedad pulmonar restrictiva es la bronquiolitis obliterante con neumonía organizada (BONO), que más recientemente se denominó neumonía organizada criptogénica (NOC). Las características clínicas incluyen tos seca, dificultad para respirar y fiebre. Los hallazgos radiográficos muestran infiltrados difusos, periféricos y esponjosos congruentes con consolidación del espacio aéreo. Aunque se ha notificado en menos del 10 % de los receptores de TCMH, la presentación de BONO/NOC se relaciona mucho con la EICH crónica o aguda previa.
Los pacientes con enfermedad pulmonar restrictiva presentan respuestas limitadas a varios fármacos, como corticoesteroides, ciclosporina, tacrólimus y azatioprina. La presunta función del factor de necrosis tumoral α en la patogenia de la enfermedad pulmonar restrictiva y obstructiva, indica que el empleo de fármacos neutralizantes como el etanercept quizá sea prometedor.
Para obtener más información, consultar la sección Complicaciones respiratorias relacionadas con un trasplante de células madre hematopoyéticas en Efectos tardíos del tratamiento anticanceroso en la niñez.
Efectos tardíos en el aparato urinario
Nefropatía
Con frecuencia, después de un trasplante se diagnostica nefropatía crónica. Hay muchas formas clínicas de nefropatía crónica, pero las que se describen con mayor frecuencia son microangiopatía trombótica, síndrome nefrótico, toxicidad por inhibidores de la calcineurina, lesión renal aguda y nefropatía crónica relacionada con la EICH. Se han descrito varios factores de riesgo relacionados con la presentación de la nefropatía crónica; sin embargo, hay estudios recientes que indican que es posible que la EICH crónica y aguda sean una causa directa de lesión renal.
En una revisión sistemática de 9317 adultos y niños de 28 cohortes sometidos a TCMH, aproximadamente el 16,6 % de los pacientes (intervalo, 3,6 % a 89 %) presentaron nefropatía crónica definida como una disminución en el cálculo de la tasa de filtración glomerular de por lo menos 24,5 ml/min/1,73 m2 dentro del primer año posterior al trasplante. La incidencia acumulada de nefropatía crónica que se presenta alrededor de 5 años después del trasplante osciló entre el 4,4 % y el 44,3 %, según el tipo de trasplante y el estadio de la nefropatía crónica. Las tasas de mortalidad entre los pacientes con nefropatía crónica en este entorno fueron más altas que las de los receptores de trasplante que conservaron un funcionamiento renal normal, incluso en los estudios con control de las comorbilidades.
Después de un TCMH, es importante tratar la hipertensión de manera intensiva, en particular en pacientes tratados con ciclos prolongados de inhibidores de la calcineurina. Se necesitan más estudios para determinar si los pacientes que después de un TCMH tienen albuminuria e hipertensión se benefician del tratamiento con inhibidores de la enzima convertidora de la angiotensina (ECA) o antagonistas de los receptores de la angiotensina; sin embargo, un control cuidadoso de la hipertensión con captopril, un inhibidor de la ECA, demostró ser beneficioso en un estudio pequeño.
Calidad de vida
Calidad de vida relacionada con la salud
La calidad de vida relacionada con la salud (CVRS) es un concepto teórico multidimensional que incorpora una evaluación subjetiva del desempeño y el bienestar en relación con el efecto de los problemas de salud en la calidad de vida en general. En muchos estudios se observó que la CVRS varía de acuerdo con los siguientes factores:
- Tiempo desde el TCMH: la CVRS es más precaria con un TCMH más reciente.
- Tipo de trasplante: el TCMH de un donante no emparentado produce una CVRS más precaria que el TCMH autógeno o alogénico de un donante emparentado.
- Presencia o ausencia de secuelas relacionadas con el TCMH: la CVRS es más precaria con una EICH crónica.
Se observó que los factores anteriores a un TCMH, como la cohesión familiar y el funcionamiento adaptativo del niño afectan la CVRS. Varios grupos también identificaron la importancia del estrés de los padres antes de un TCMH en la evaluación de la CVRS de los niños luego de un TCMH. En un informe de las trayectorias de la CVRS después de 12 meses de un TCMH, se notó que la CVRS más precaria se observó 3 meses después de un TCMH, con una mejora persistente de allí en adelante. Los receptores de donantes no emparentados presentaron la disminución más abrupta de la CVRS desde el inicio hasta 3 meses después. En otro estudio se notificó que el compromiso del funcionamiento emocional, grados altos de preocupación y reducción de la comunicación durante el período agudo de recuperación tuvieron una repercusión negativa en la CVRS 1 año después de un TCMH. En estudios longitudinales se identificó un vínculo entre los siguientes factores de riesgo al inicio del estudio con la trayectoria de la CVRS después de un TCMH:
- Edad del niño. Los niños de mayor edad presentaron peor CVRS.
- Sexo del niño. Las niñas presentaron peor CVRS.
- Sesgo de la persona que evalúa la CVRS. Las madres notificaron una CVRS más baja que los padres; cualquiera de los padres notificó una CVRS más baja que el niño o la niña.
- Concordancia por idioma principal o por sexo de la persona que evalúa la CRVS. Pares concordantes notificaron una CVRS más alta.
- Sufrimiento emocional de los padres. Un mayor sufrimiento emocional de los padres derivó en una CVRS más precaria.
- Raza del niño. Los niños afroamericanos tuvieron mejor CVRS.
En un informe en el que se estudió el efecto de complicaciones específicas del TCMH, se indicó que la CVRS fue más precaria en los niños con toxicidad orgánica grave, infección sistémica o EICH. En estudios transversales en el entorno pediátrico se notificó que la CVRS entre sobrevivientes a 5 años o más de TCMH fue razonablemente buena, mientras que los problemas psicológicos, cognitivos o fisiológicos afectaron de forma negativa la CVRS. El sexo femenino, el diagnóstico causal de un TCMH (por ejemplo, los pacientes con leucemia mielógena aguda tuvieron una CVRS más precaria) y la intensidad de la terapia previa al TCMH se identificaron como factores que afectan la CVRS después de un TCMH. Por último, en otro estudio transversal de niños al cabo de 5 a 10 años de un TCMH se advirtió que las preocupaciones de los padres sobre la vulnerabilidad del niño los induce, en ocasiones, a ser padres sobreprotectores.
Resultados funcionales
Informe médico sobre el rendimiento físico
Los informes médicos sobre la incapacidad a largo plazo en niños sobrevivientes de TCMH indican que la prevalencia y gravedad de la pérdida funcional es baja, como se observó en los siguientes estudios:
- En un estudio del European Group for Blood and Marrow Transplantation se empleó la escala de rendimiento de Karnofsky para notificar los desenlaces de 647 sobrevivientes de TCMH (supervivencia ≥5 años). En esta cohorte, el 40 % de los sobrevivientes eran menores de 18 años cuando recibieron el trasplante; solo el 19 % presentaron puntajes de Karnofsky menores de 100. El 7 % tuvieron puntajes menores de 80, que se definió como incapacidad para trabajar. Otros 2 grupos notificaron tasas bajas similares de rendimiento funcional precario evaluado por profesionales clínicos.
- Entre 50 sobrevivientes de TCMH alogénico en la niñez tratados en el City of Hope National Medical Center y el Stanford University Hospital, todos presentaron un puntaje de Karnofsky de 90 o 100.
- Entre 73 adultos jóvenes (media de edad, 26 años) tratados en el Karolinska University Hospital, la mediana del puntaje de Karnofsky 10 años después del TCMH fue de 90.
Autonotificación del rendimiento físico
Los autoinformes y los datos provistos por apoderados de sobrevivientes de TCMH en la niñez indican tasas similares bajas de pérdida funcional.
- En un estudio se evaluó a 22 sobrevivientes de TCMH alogénico en la niñez (media de edad en el momento del TCMH, 11 años; media de edad en el momento de responder el cuestionario, 25 años) y no se notificaron diferencias entre el puntaje de los sobrevivientes y los valores esperados de la población en las escalas estandarizadas de rendimiento físico.
- En otro estudio se comparó a un grupo de sobrevivientes sometidos a trasplante por leucemia infantil (n = 142) con un grupo de sobrevivientes de leucemia infantil tratados con quimioterapia sola (n = 288). No hubo diferencias entre los grupos en las escalas de funcionamiento físico y esparcimiento con el uso de múltiples mediciones estandarizadas.
Otros estudios en los que se informaron limitaciones funcionales son los siguientes:
- En el Bone Marrow Transplant Survivors Study (BMTSS), de 235 sobrevivientes de TCMH infantil, el 17 % informaron limitaciones en el rendimiento físico a largo plazo en comparación con el 8,7 % de un grupo de comparación de hermanos.
- En un estudio realizado en Seattle, se evaluó el funcionamiento físico de 214 adultos jóvenes (mediana de edad en el momento del cuestionario, 28,7 años; 118 varones) sometidos a trasplante a una mediana de edad de 11,9 años. Cuando se los comparó con controles emparejados por sexo y edad, los sobrevivientes de TCMH en esta cohorte tuvieron puntajes ubicados media desviación estándar por debajo para el puntaje de las mediciones de calidad de vida del componente físico de la SF-36, y de las subescalas de funcionamiento físico y tareas físicas.
- En un estudio realizado en Suecia también se identificó una salud física autonotificada más baja en 73 adultos jóvenes (mediana de edad, 26 años) sobrevivientes de TCMH después de una mediana de tiempo de 10 años desde el trasplante. Los sobrevivientes de TCMH tuvieron puntajes significativamente más bajos que los valores normales de la población en cuanto al funcionamiento físico (90,2 en sobrevivientes de TCMH vs. 95,3 en la población), satisfacción con la salud física (66,0 en los sobrevivientes de TCMH vs. 78,7 en la población) y limitación del desempeño debido a la salud física (72,7 en los sobrevivientes de TCMH vs. 84,9 en la población.
Medición del rendimiento físico
Las mediciones objetivas del funcionamiento en la población pediátrica de pacientes y sobrevivientes de TCMH indican que la pérdida de la capacidad física quizás sea un problema mayor al que se expuso en estudios que se sustentan en datos notificados por pacientes o profesionales clínicos. En los estudios en los que se mide la capacidad cardiopulmonar se observó lo siguiente:
- En un estudio se usó la capacidad para ejercitarse medida por cicloergometría en un grupo formado por 20 niños y adultos jóvenes evaluados antes del TCMH, 31 pacientes evaluados 1 año después del TCMH y 70 controles sanos. El promedio de consumo máximo de oxígeno fue de 21 ml/kg/min en el grupo evaluado antes del TCMH, 24 ml/kg/min en el grupo evaluado después del TCMH y 34 ml/kg/min en los controles sanos. Entre los sobrevivientes de TCMH, el 62 % de los casos con un diagnóstico de cáncer tuvieron un puntaje en el quinto percentil más bajo para el consumo máximo de oxígeno en comparación con los controles sanos.
- En otro estudio, se examinó la capacidad de realizar ejercicio de 31 sobrevivientes de TCMH infantil con un protocolo de Bruce en una cinta sin fin (banda ergométrica). En esta cohorte, el 25,8 % de los sobrevivientes de TCMH tenían una capacidad de ejercicio del 70 % al 79 % de la categoría pronosticada y el 41,9 % tenían una capacidad de ejercicio de menos del 70 % de la categoría pronosticada.
- En un tercer estudio se evaluó la capacidad de realizar ejercicio en 33 sobrevivientes de TCMH que se sometieron a trasplante a una media de edad de 11,3 años. A los 5 años del TCMH solo 4 de los 33 sobrevivientes obtuvo un puntaje superior al percentil 75 en una prueba de cicloergometría.
Factores pronósticos del rendimiento físico precario
El BMTSS encontró vínculos entre un rendimiento físico precario y la EICH crónica, afecciones cardíacas, inmunodepresión o tratamiento de una segunda neoplasia maligna. En el estudio del Fred Hutchison Cancer Research Center, el rendimiento precario se relacionó con enfermedad mieloide.
Pautas publicadas para el seguimiento a largo plazo
Varias organizaciones han formulado pautas de consenso para el seguimiento de los efectos tardíos luego de un TCMH. El CIBMTR junto con la American Society of Blood and Marrow Transplant (ASBMT) y en cooperación con otros 5 grupos internacionales de trasplante, publicaron recomendaciones de consenso para la práctica de exámenes de detección y las intervenciones de prevención para los sobrevivientes a largo plazo de TCMH.
Aunque en estas pautas se abordan algunos retos del entorno pediátrico, no se incluyen muchos temas importantes en pediatría. Algunos de estos temas se abordaron parcialmente en pautas generales publicadas por el Children's Oncology Group (COG) y otros grupos dedicados al estudio del cáncer infantil en Reino Unido, Escocia y Países Bajos. El COG también publicó recomendaciones más específicas para la vigilancia de los efectos tardíos del TCMH. A fin de abordar la falta de datos más precisos propios del entorno pediátrico sobre los efectos tardíos y las pautas para el seguimiento a largo plazo luego de un TCMH, el Pediatric Blood and Marrow Transplant Consortium (PBMTC) publicó 6 documentos detallados que delinean los datos actuales y sintetizan las recomendaciones de grupos clave (CIBMTR/ASBMT, COG y el grupo del Reino Unido) junto con recomendaciones de expertos en aspectos propios del entorno pediátrico.
Si bien los esfuerzos internacionales para una mayor estandarización y armonización de las pautas de seguimiento específicas para el entorno pediátrico aún están en curso, las recomendaciones en forma de resumen y las pautas del PBMTC proveen el esquema más actualizado para el seguimiento de los efectos tardíos de un TCMH en niños.
References
- Sun CL, Francisco L, Kawashima T, et al.: Prevalence and predictors of chronic health conditions after hematopoietic cell transplantation: a report from the Bone Marrow Transplant Survivor Study. Blood 116 (17): 3129-39; quiz 3377, 2010.
- Bhatia S, Francisco L, Carter A, et al.: Late mortality after allogeneic hematopoietic cell transplantation and functional status of long-term survivors: report from the Bone Marrow Transplant Survivor Study. Blood 110 (10): 3784-92, 2007.
- Holmqvist AS, Chen Y, Hageman L, et al.: Severe, life-threatening, and fatal chronic health conditions after allogeneic blood or marrow transplantation in childhood. Cancer 129 (4): 624-633, 2023.
- Bhatia S, Robison LL, Francisco L, et al.: Late mortality in survivors of autologous hematopoietic-cell transplantation: report from the Bone Marrow Transplant Survivor Study. Blood 105 (11): 4215-22, 2005.
- Gooley TA, Chien JW, Pergam SA, et al.: Reduced mortality after allogeneic hematopoietic-cell transplantation. N Engl J Med 363 (22): 2091-101, 2010.
- Martin PJ, Counts GW, Appelbaum FR, et al.: Life expectancy in patients surviving more than 5 years after hematopoietic cell transplantation. J Clin Oncol 28 (6): 1011-6, 2010.
- Geenen MM, Cardous-Ubbink MC, Kremer LC, et al.: Medical assessment of adverse health outcomes in long-term survivors of childhood cancer. JAMA 297 (24): 2705-15, 2007.
- Oeffinger KC, Mertens AC, Sklar CA, et al.: Chronic health conditions in adult survivors of childhood cancer. N Engl J Med 355 (15): 1572-82, 2006.
- Bhatia S, Davies SM, Scott Baker K, et al.: NCI, NHLBI first international consensus conference on late effects after pediatric hematopoietic cell transplantation: etiology and pathogenesis of late effects after HCT performed in childhood--methodologic challenges. Biol Blood Marrow Transplant 17 (10): 1428-35, 2011.
- Behar E, Chao NJ, Hiraki DD, et al.: Polymorphism of adhesion molecule CD31 and its role in acute graft-versus-host disease. N Engl J Med 334 (5): 286-91, 1996.
- Goodman RS, Ewing J, Evans PC, et al.: Donor CD31 genotype and its association with acute graft-versus-host disease in HLA identical sibling stem cell transplantation. Bone Marrow Transplant 36 (2): 151-6, 2005.
- van Dalen EC, van der Pal HJ, Kok WE, et al.: Clinical heart failure in a cohort of children treated with anthracyclines: a long-term follow-up study. Eur J Cancer 42 (18): 3191-8, 2006.
- Duncan CN, Brazauskas R, Huang J, et al.: Late cardiovascular morbidity and mortality following pediatric allogeneic hematopoietic cell transplantation. Bone Marrow Transplant 53 (10): 1278-1287, 2018.
- Chow EJ, Mueller BA, Baker KS, et al.: Cardiovascular hospitalizations and mortality among recipients of hematopoietic stem cell transplantation. Ann Intern Med 155 (1): 21-32, 2011.
- Armenian SH, Sun CL, Francisco L, et al.: Late congestive heart failure after hematopoietic cell transplantation. J Clin Oncol 26 (34): 5537-43, 2008.
- Armenian SH, Sun CL, Mills G, et al.: Predictors of late cardiovascular complications in survivors of hematopoietic cell transplantation. Biol Blood Marrow Transplant 16 (8): 1138-44, 2010.
- Armenian SH, Sun CL, Kawashima T, et al.: Long-term health-related outcomes in survivors of childhood cancer treated with HSCT versus conventional therapy: a report from the Bone Marrow Transplant Survivor Study (BMTSS) and Childhood Cancer Survivor Study (CCSS). Blood 118 (5): 1413-20, 2011.
- Arvidson J, Kihlgren M, Hall C, et al.: Neuropsychological functioning after treatment for hematological malignancies in childhood, including autologous bone marrow transplantation. Pediatr Hematol Oncol 16 (1): 9-21, 1999 Jan-Feb.
- Barrera M, Atenafu E: Cognitive, educational, psychosocial adjustment and quality of life of children who survive hematopoietic SCT and their siblings. Bone Marrow Transplant 42 (1): 15-21, 2008.
- Kupst MJ, Penati B, Debban B, et al.: Cognitive and psychosocial functioning of pediatric hematopoietic stem cell transplant patients: a prospective longitudinal study. Bone Marrow Transplant 30 (9): 609-17, 2002.
- Phipps S, Brenner M, Heslop H, et al.: Psychological effects of bone marrow transplantation on children and adolescents: preliminary report of a longitudinal study. Bone Marrow Transplant 15 (6): 829-35, 1995.
- Phipps S, Rai SN, Leung WH, et al.: Cognitive and academic consequences of stem-cell transplantation in children. J Clin Oncol 26 (12): 2027-33, 2008.
- Phipps S, Dunavant M, Srivastava DK, et al.: Cognitive and academic functioning in survivors of pediatric bone marrow transplantation. J Clin Oncol 18 (5): 1004-11, 2000.
- Cognitive functioning after BMT. In: Pot-Mees CC: The Psychological Effects of Bone Marrow Transplantation in Children. Eburon Delft, 1989, pp 96–103.
- Simms S, Kazak AE, Golomb V, et al.: Cognitive, behavioral, and social outcome in survivors of childhood stem cell transplantation. J Pediatr Hematol Oncol 24 (2): 115-9, 2002.
- Cool VA: Long-term neuropsychological risks in pediatric bone marrow transplant: what do we know? Bone Marrow Transplant 18 (Suppl 3): S45-9, 1996.
- Kramer JH, Crittenden MR, DeSantes K, et al.: Cognitive and adaptive behavior 1 and 3 years following bone marrow transplantation. Bone Marrow Transplant 19 (6): 607-13, 1997.
- Kramer JH, Crittenden MR, Halberg FE, et al.: A prospective study of cognitive functioning following low-dose cranial radiation for bone marrow transplantation. Pediatrics 90 (3): 447-50, 1992.
- Shah AJ, Epport K, Azen C, et al.: Progressive declines in neurocognitive function among survivors of hematopoietic stem cell transplantation for pediatric hematologic malignancies. J Pediatr Hematol Oncol 30 (6): 411-8, 2008.
- Smedler AC, Bolme P: Neuropsychological deficits in very young bone marrow transplant recipients. Acta Paediatr 84 (4): 429-33, 1995.
- Smedler AC, Winiarski J: Neuropsychological outcome in very young hematopoietic SCT recipients in relation to pretransplant conditioning. Bone Marrow Transplant 42 (8): 515-22, 2008.
- Willard VW, Leung W, Huang Q, et al.: Cognitive outcome after pediatric stem-cell transplantation: impact of age and total-body irradiation. J Clin Oncol 32 (35): 3982-8, 2014.
- McDonald GB: Hepatobiliary complications of hematopoietic cell transplantation, 40 years on. Hepatology 51 (4): 1450-60, 2010.
- Nieder ML, McDonald GB, Kida A, et al.: National Cancer Institute-National Heart, Lung and Blood Institute/pediatric Blood and Marrow Transplant Consortium First International Consensus Conference on late effects after pediatric hematopoietic cell transplantation: long-term organ damage and dysfunction. Biol Blood Marrow Transplant 17 (11): 1573-84, 2011.
- Mackey JR, Desai S, Larratt L, et al.: Myasthenia gravis in association with allogeneic bone marrow transplantation: clinical observations, therapeutic implications and review of literature. Bone Marrow Transplant 19 (9): 939-42, 1997.
- Shimada K, Yokozawa T, Atsuta Y, et al.: Solid tumors after hematopoietic stem cell transplantation in Japan: incidence, risk factors and prognosis. Bone Marrow Transplant 36 (2): 115-21, 2005.
- McDonald GB, Sullivan KM, Schuffler MD, et al.: Esophageal abnormalities in chronic graft-versus-host disease in humans. Gastroenterology 80 (5 pt 1): 914-21, 1981.
- McDonald GB, Sullivan KM, Plumley TF: Radiographic features of esophageal involvement in chronic graft-vs.-host disease. AJR Am J Roentgenol 142 (3): 501-6, 1984.
- Schima W, Pokieser P, Forstinger C, et al.: Videofluoroscopy of the pharynx and esophagus in chronic graft-versus-host disease. Abdom Imaging 19 (3): 191-4, 1994 May-Jun.
- Minocha A, Mandanas RA, Kida M, et al.: Bullous esophagitis due to chronic graft-versus-host disease. Am J Gastroenterol 92 (3): 529-30, 1997.
- Patey-Mariaud de Serre N, Reijasse D, Verkarre V, et al.: Chronic intestinal graft-versus-host disease: clinical, histological and immunohistochemical analysis of 17 children. Bone Marrow Transplant 29 (3): 223-30, 2002.
- Akpek G, Chinratanalab W, Lee LA, et al.: Gastrointestinal involvement in chronic graft-versus-host disease: a clinicopathologic study. Biol Blood Marrow Transplant 9 (1): 46-51, 2003.
- Filipovich AH, Weisdorf D, Pavletic S, et al.: National Institutes of Health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: I. Diagnosis and staging working group report. Biol Blood Marrow Transplant 11 (12): 945-56, 2005.
- McDonald GB, Bouvier M, Hockenbery DM, et al.: Oral beclomethasone dipropionate for treatment of intestinal graft-versus-host disease: a randomized, controlled trial. Gastroenterology 115 (1): 28-35, 1998.
- Hockenbery DM, Cruickshank S, Rodell TC, et al.: A randomized, placebo-controlled trial of oral beclomethasone dipropionate as a prednisone-sparing therapy for gastrointestinal graft-versus-host disease. Blood 109 (10): 4557-63, 2007.
- Iyer RV, Hahn T, Roy HN, et al.: Long-term use of oral beclomethasone dipropionate for the treatment of gastrointestinal graft-versus-host disease. Biol Blood Marrow Transplant 11 (8): 587-92, 2005.
- Borgaonkar MR, Duggan PR, Adams G: Differing clinical manifestations of celiac disease transmitted by bone marrow transplantation. Dig Dis Sci 51 (1): 210-2, 2006.
- Sullivan KM, Shulman HM, Storb R, et al.: Chronic graft-versus-host disease in 52 patients: adverse natural course and successful treatment with combination immunosuppression. Blood 57 (2): 267-76, 1981.
- Tomás JF, Pinilla I, García-Buey ML, et al.: Long-term liver dysfunction after allogeneic bone marrow transplantation: clinical features and course in 61 patients. Bone Marrow Transplant 26 (6): 649-55, 2000.
- Strasser SI, Shulman HM, Flowers ME, et al.: Chronic graft-versus-host disease of the liver: presentation as an acute hepatitis. Hepatology 32 (6): 1265-71, 2000.
- Malik AH, Collins RH, Saboorian MH, et al.: Chronic graft-versus-host disease after hematopoietic cell transplantation presenting as an acute hepatitis. Am J Gastroenterol 96 (2): 588-90, 2001.
- Akpek G, Boitnott JK, Lee LA, et al.: Hepatitic variant of graft-versus-host disease after donor lymphocyte infusion. Blood 100 (12): 3903-7, 2002.
- Shulman HM, Sharma P, Amos D, et al.: A coded histologic study of hepatic graft-versus-host disease after human bone marrow transplantation. Hepatology 8 (3): 463-70, 1988 May-Jun.
- Strasser SI, Myerson D, Spurgeon CL, et al.: Hepatitis C virus infection and bone marrow transplantation: a cohort study with 10-year follow-up. Hepatology 29 (6): 1893-9, 1999.
- Ljungman P, Johansson N, Aschan J, et al.: Long-term effects of hepatitis C virus infection in allogeneic bone marrow transplant recipients. Blood 86 (4): 1614-8, 1995.
- Strasser SI, Sullivan KM, Myerson D, et al.: Cirrhosis of the liver in long-term marrow transplant survivors. Blood 93 (10): 3259-66, 1999.
- Peffault de Latour R, Lévy V, Asselah T, et al.: Long-term outcome of hepatitis C infection after bone marrow transplantation. Blood 103 (5): 1618-24, 2004.
- Ko CW, Murakami C, Sekijima JH, et al.: Chemical composition of gallbladder sludge in patients after marrow transplantation. Am J Gastroenterol 91 (6): 1207-10, 1996.
- Akpek G, Valladares JL, Lee L, et al.: Pancreatic insufficiency in patients with chronic graft-versus-host disease. Bone Marrow Transplant 27 (2): 163-6, 2001.
- Maringhini A, Gertz MA, DiMagno EP: Exocrine pancreatic insufficiency after allogeneic bone marrow transplantation. Int J Pancreatol 17 (3): 243-7, 1995.
- Radu B, Allez M, Gornet JM, et al.: Chronic diarrhoea after allogenic bone marrow transplantation. Gut 54 (1): 161, 174, 2005.
- Mariotti E, Angelucci E, Agostini A, et al.: Evaluation of cardiac status in iron-loaded thalassaemia patients following bone marrow transplantation: improvement in cardiac function during reduction in body iron burden. Br J Haematol 103 (4): 916-21, 1998.
- Angelucci E, Muretto P, Lucarelli G, et al.: Treatment of iron overload in the "ex-thalassemic". Report from the phlebotomy program. Ann N Y Acad Sci 850: 288-93, 1998.
- Pulsipher MA, Skinner R, McDonald GB, et al.: National Cancer Institute, National Heart, Lung and Blood Institute/Pediatric Blood and Marrow Transplantation Consortium First International Consensus Conference on late effects after pediatric hematopoietic cell transplantation: the need for pediatric-specific long-term follow-up guidelines. Biol Blood Marrow Transplant 18 (3): 334-47, 2012.
- Sanders JE, Hoffmeister PA, Woolfrey AE, et al.: Thyroid function following hematopoietic cell transplantation in children: 30 years' experience. Blood 113 (2): 306-8, 2009.
- Bailey HK, Kappy MS, Giller RH, et al.: Time-course and risk factors of hypothyroidism following allogeneic hematopoietic stem cell transplantation (HSCT) in children conditioned with fractionated total body irradiation. Pediatr Blood Cancer 51 (3): 405-9, 2008.
- Ishiguro H, Yasuda Y, Tomita Y, et al.: Long-term follow-up of thyroid function in patients who received bone marrow transplantation during childhood and adolescence. J Clin Endocrinol Metab 89 (12): 5981-6, 2004.
- Michel G, Socié G, Gebhard F, et al.: Late effects of allogeneic bone marrow transplantation for children with acute myeloblastic leukemia in first complete remission: the impact of conditioning regimen without total-body irradiation--a report from the Société Française de Greffe de Moelle. J Clin Oncol 15 (6): 2238-46, 1997.
- Afify Z, Shaw PJ, Clavano-Harding A, et al.: Growth and endocrine function in children with acute myeloid leukaemia after bone marrow transplantation using busulfan/cyclophosphamide. Bone Marrow Transplant 25 (10): 1087-92, 2000.
- Slatter MA, Gennery AR, Cheetham TD, et al.: Thyroid dysfunction after bone marrow transplantation for primary immunodeficiency without the use of total body irradiation in conditioning. Bone Marrow Transplant 33 (9): 949-53, 2004.
- Berger C, Le-Gallo B, Donadieu J, et al.: Late thyroid toxicity in 153 long-term survivors of allogeneic bone marrow transplantation for acute lymphoblastic leukaemia. Bone Marrow Transplant 35 (10): 991-5, 2005.
- Leung W, Ahn H, Rose SR, et al.: A prospective cohort study of late sequelae of pediatric allogeneic hematopoietic stem cell transplantation. Medicine (Baltimore) 86 (4): 215-24, 2007.
- Dvorak CC, Wright NB, Wong WB, et al.: Safety of hematopoietic stem cell transplantation in children less than three years of age. Pediatr Hematol Oncol 25 (8): 705-22, 2008.
- Sanders JE, Woolfrey AE, Carpenter PA, et al.: Late effects among pediatric patients followed for nearly 4 decades after transplantation for severe aplastic anemia. Blood 118 (5): 1421-8, 2011.
- Cattoni A, Molinari S, Gaiero A, et al.: Thyroid Disorders Following Hematopoietic Stem Cell Transplantation in Childhood: Impact of Conditioning Regimen on Thyroid Dysfunction, Volume Changes, and Occurrence of Nodules. Transplant Cell Ther 28 (8): 506.e1-506.e12, 2022.
- Socié G, Salooja N, Cohen A, et al.: Nonmalignant late effects after allogeneic stem cell transplantation. Blood 101 (9): 3373-85, 2003.
- Katsanis E, Shapiro RS, Robison LL, et al.: Thyroid dysfunction following bone marrow transplantation: long-term follow-up of 80 pediatric patients. Bone Marrow Transplant 5 (5): 335-40, 1990.
- Savani BN, Koklanaris EK, Le Q, et al.: Prolonged chronic graft-versus-host disease is a risk factor for thyroid failure in long-term survivors after matched sibling donor stem cell transplantation for hematologic malignancies. Biol Blood Marrow Transplant 15 (3): 377-81, 2009.
- Huma Z, Boulad F, Black P, et al.: Growth in children after bone marrow transplantation for acute leukemia. Blood 86 (2): 819-24, 1995.
- Giorgiani G, Bozzola M, Locatelli F, et al.: Role of busulfan and total body irradiation on growth of prepubertal children receiving bone marrow transplantation and results of treatment with recombinant human growth hormone. Blood 86 (2): 825-31, 1995.
- Cohen A, Rovelli A, Van-Lint MT, et al.: Final height of patients who underwent bone marrow transplantation during childhood. Arch Dis Child 74 (5): 437-40, 1996.
- Sanders JE, Guthrie KA, Hoffmeister PA, et al.: Final adult height of patients who received hematopoietic cell transplantation in childhood. Blood 105 (3): 1348-54, 2005.
- Cohen A, Rovelli A, Bakker B, et al.: Final height of patients who underwent bone marrow transplantation for hematological disorders during childhood: a study by the Working Party for Late Effects-EBMT. Blood 93 (12): 4109-15, 1999.
- Eggleston B, Patience M, Edwards S, et al.: Effect of myeloablative bone marrow transplantation on growth in children with sickle cell anaemia: results of the multicenter study of haematopoietic cell transplantation for sickle cell anaemia. Br J Haematol 136 (4): 673-6, 2007.
- Reusch JE: Current concepts in insulin resistance, type 2 diabetes mellitus, and the metabolic syndrome. Am J Cardiol 90 (5A): 19G-26G, 2002.
- Trevisan M, Liu J, Bahsas FB, et al.: Syndrome X and mortality: a population-based study. Risk Factor and Life Expectancy Research Group. Am J Epidemiol 148 (10): 958-66, 1998.
- Lakka HM, Laaksonen DE, Lakka TA, et al.: The metabolic syndrome and total and cardiovascular disease mortality in middle-aged men. JAMA 288 (21): 2709-16, 2002.
- Taskinen M, Saarinen-Pihkala UM, Hovi L, et al.: Impaired glucose tolerance and dyslipidaemia as late effects after bone-marrow transplantation in childhood. Lancet 356 (9234): 993-7, 2000.
- Baker KS, Ness KK, Steinberger J, et al.: Diabetes, hypertension, and cardiovascular events in survivors of hematopoietic cell transplantation: a report from the bone marrow transplantation survivor study. Blood 109 (4): 1765-72, 2007.
- Eaton SB, Cordain L, Sparling PB: Evolution, body composition, insulin receptor competition, and insulin resistance. Prev Med 49 (4): 283-5, 2009.
- Boirie Y: Physiopathological mechanism of sarcopenia. J Nutr Health Aging 13 (8): 717-23, 2009.
- Baker KS, Chow E, Goodman P, et al.: Adverse Impact of hematopoietic cell transplantation (HCT) on body composition and insulin resistance (IR) is associated with increased cardiovascular risk. [Abstract] Biol Blood Marrow Transplant 17 (2 Suppl): A-61, S174, 2011.
- Cook S, Weitzman M, Auinger P, et al.: Prevalence of a metabolic syndrome phenotype in adolescents: findings from the third National Health and Nutrition Examination Survey, 1988-1994. Arch Pediatr Adolesc Med 157 (8): 821-7, 2003.
- Genuth S, Alberti KG, Bennett P, et al.: Follow-up report on the diagnosis of diabetes mellitus. Diabetes Care 26 (11): 3160-7, 2003.
- Grundy SM, Brewer HB, Cleeman JI, et al.: Definition of metabolic syndrome: Report of the National Heart, Lung, and Blood Institute/American Heart Association conference on scientific issues related to definition. Circulation 109 (3): 433-8, 2004.
- Petryk A, Bergemann TL, Polga KM, et al.: Prospective study of changes in bone mineral density and turnover in children after hematopoietic cell transplantation. J Clin Endocrinol Metab 91 (3): 899-905, 2006.
- Bhatia S, Ramsay NK, Weisdorf D, et al.: Bone mineral density in patients undergoing bone marrow transplantation for myeloid malignancies. Bone Marrow Transplant 22 (1): 87-90, 1998.
- Nysom K, Holm K, Michaelsen KF, et al.: Bone mass after allogeneic BMT for childhood leukaemia or lymphoma. Bone Marrow Transplant 25 (2): 191-6, 2000.
- Daniels MW, Wilson DM, Paguntalan HG, et al.: Bone mineral density in pediatric transplant recipients. Transplantation 76 (4): 673-8, 2003.
- Kaste SC, Shidler TJ, Tong X, et al.: Bone mineral density and osteonecrosis in survivors of childhood allogeneic bone marrow transplantation. Bone Marrow Transplant 33 (4): 435-41, 2004.
- Perkins JL, Kunin-Batson AS, Youngren NM, et al.: Long-term follow-up of children who underwent hematopoeitic cell transplant (HCT) for AML or ALL at less than 3 years of age. Pediatr Blood Cancer 49 (7): 958-63, 2007.
- Carpenter PA, Hoffmeister P, Chesnut CH, et al.: Bisphosphonate therapy for reduced bone mineral density in children with chronic graft-versus-host disease. Biol Blood Marrow Transplant 13 (6): 683-90, 2007.
- Weilbaecher KN: Mechanisms of osteoporosis after hematopoietic cell transplantation. Biol Blood Marrow Transplant 6 (2A): 165-74, 2000.
- Rodgers C, Monroe R: Osteopenia and osteoporosis in pediatric patients after stem cell transplant. J Pediatr Oncol Nurs 24 (4): 184-9, 2007 Jul-Aug.
- McClune BL, Polgreen LE, Burmeister LA, et al.: Screening, prevention and management of osteoporosis and bone loss in adult and pediatric hematopoietic cell transplant recipients. Bone Marrow Transplant 46 (1): 1-9, 2011.
- Schulte CM, Beelen DW: Bone loss following hematopoietic stem cell transplantation: a long-term follow-up. Blood 103 (10): 3635-43, 2004.
- Schimmer AD, Minden MD, Keating A: Osteoporosis after blood and marrow transplantation: clinical aspects. Biol Blood Marrow Transplant 6 (2A): 175-81, 2000.
- Banfi A, Podestà M, Fazzuoli L, et al.: High-dose chemotherapy shows a dose-dependent toxicity to bone marrow osteoprogenitors: a mechanism for post-bone marrow transplantation osteopenia. Cancer 92 (9): 2419-28, 2001.
- Castañeda S, Carmona L, Carvajal I, et al.: Reduction of bone mass in women after bone marrow transplantation. Calcif Tissue Int 60 (4): 343-7, 1997.
- Lee WY, Baek KH, Rhee EJ, et al.: Impact of circulating bone-resorbing cytokines on the subsequent bone loss following bone marrow transplantation. Bone Marrow Transplant 34 (1): 89-94, 2004.
- Baker KS, Gurney JG, Ness KK, et al.: Late effects in survivors of chronic myeloid leukemia treated with hematopoietic cell transplantation: results from the Bone Marrow Transplant Survivor Study. Blood 104 (6): 1898-906, 2004.
- Stern JM, Sullivan KM, Ott SM, et al.: Bone density loss after allogeneic hematopoietic stem cell transplantation: a prospective study. Biol Blood Marrow Transplant 7 (5): 257-64, 2001.
- Ebeling PR, Thomas DM, Erbas B, et al.: Mechanisms of bone loss following allogeneic and autologous hemopoietic stem cell transplantation. J Bone Miner Res 14 (3): 342-50, 1999.
- Tauchmanovà L, De Rosa G, Serio B, et al.: Avascular necrosis in long-term survivors after allogeneic or autologous stem cell transplantation: a single center experience and a review. Cancer 97 (10): 2453-61, 2003.
- Kananen K, Volin L, Tähtelä R, et al.: Recovery of bone mass and normalization of bone turnover in long-term survivors of allogeneic bone marrow transplantation. Bone Marrow Transplant 29 (1): 33-9, 2002.
- Socié G, Cahn JY, Carmelo J, et al.: Avascular necrosis of bone after allogeneic bone marrow transplantation: analysis of risk factors for 4388 patients by the Société Française de Greffe de Moëlle (SFGM). Br J Haematol 97 (4): 865-70, 1997.
- Faraci M, Calevo MG, Lanino E, et al.: Osteonecrosis after allogeneic stem cell transplantation in childhood. A case-control study in Italy. Haematologica 91 (8): 1096-9, 2006.
- Enright H, Haake R, Weisdorf D: Avascular necrosis of bone: a common serious complication of allogeneic bone marrow transplantation. Am J Med 89 (6): 733-8, 1990.
- Sharma S, Yang S, Rochester R, et al.: Prevalence of osteonecrosis and associated risk factors in children before allogeneic BMT. Bone Marrow Transplant 46 (6): 813-9, 2011.
- Bürger B, Beier R, Zimmermann M, et al.: Osteonecrosis: a treatment related toxicity in childhood acute lymphoblastic leukemia (ALL)--experiences from trial ALL-BFM 95. Pediatr Blood Cancer 44 (3): 220-5, 2005.
- Mattano LA, Sather HN, Trigg ME, et al.: Osteonecrosis as a complication of treating acute lymphoblastic leukemia in children: a report from the Children's Cancer Group. J Clin Oncol 18 (18): 3262-72, 2000.
- Li X, Brazauskas R, Wang Z, et al.: Avascular necrosis of bone after allogeneic hematopoietic cell transplantation in children and adolescents. Biol Blood Marrow Transplant 20 (4): 587-92, 2014.
- Baker KS, Petryk A: Growth and development after hematopoietic cell transplantation. In: Appelbaum FR, Forman SJ, Negrin RS, et al., eds.: Thomas' Hematopoietic Cell Transplantation: Stem Cell Transplantation. 5th ed. John Wiley & Sons Inc., 2015, pp 1257-65.
- Sanders JE, Flournoy N, Thomas ED, et al.: Marrow transplant experience in children with acute lymphoblastic leukemia: an analysis of factors associated with survival, relapse, and graft-versus-host disease. Med Pediatr Oncol 13 (4): 165-72, 1985.
- Sanders JE, Hawley J, Levy W, et al.: Pregnancies following high-dose cyclophosphamide with or without high-dose busulfan or total-body irradiation and bone marrow transplantation. Blood 87 (7): 3045-52, 1996.
- Carter A, Robison LL, Francisco L, et al.: Prevalence of conception and pregnancy outcomes after hematopoietic cell transplantation: report from the Bone Marrow Transplant Survivor Study. Bone Marrow Transplant 37 (11): 1023-9, 2006.
- Salooja N, Szydlo RM, Socie G, et al.: Pregnancy outcomes after peripheral blood or bone marrow transplantation: a retrospective survey. Lancet 358 (9278): 271-6, 2001.
- Loren AW, Chow E, Jacobsohn DA, et al.: Pregnancy after hematopoietic cell transplantation: a report from the late effects working committee of the Center for International Blood and Marrow Transplant Research (CIBMTR). Biol Blood Marrow Transplant 17 (2): 157-66, 2011.
- Shalet SM, Didi M, Ogilvy-Stuart AL, et al.: Growth and endocrine function after bone marrow transplantation. Clin Endocrinol (Oxf) 42 (4): 333-9, 1995.
- Schubert MA, Sullivan KM, Schubert MM, et al.: Gynecological abnormalities following allogeneic bone marrow transplantation. Bone Marrow Transplant 5 (6): 425-30, 1990.
- Howell SJ, Shalet SM: Spermatogenesis after cancer treatment: damage and recovery. J Natl Cancer Inst Monogr (34): 12-7, 2005.
- Anserini P, Chiodi S, Spinelli S, et al.: Semen analysis following allogeneic bone marrow transplantation. Additional data for evidence-based counselling. Bone Marrow Transplant 30 (7): 447-51, 2002.
- Panasiuk A, Nussey S, Veys P, et al.: Gonadal function and fertility after stem cell transplantation in childhood: comparison of a reduced intensity conditioning regimen containing melphalan with a myeloablative regimen containing busulfan. Br J Haematol 170 (5): 719-26, 2015.
- Leiper A, Houwing M, Davies EG, et al.: Anti-Müllerian hormone and Inhibin B after stem cell transplant in childhood: a comparison of myeloablative, reduced intensity and treosulfan-based chemotherapy regimens. Bone Marrow Transplant 55 (10): 1985-1995, 2020.
- Bender JD, Oquendo-Del Toro H, Benoit J, et al.: Reduced-Intensity Conditioning Mitigates Risk for Primary Ovarian Insufficiency but Does Not Decrease Risk for Infertility in Pediatric and Young Adult Survivors of Hematopoietic Stem Cell Transplantation. Transplant Cell Ther 29 (2): 130.e1-130.e8, 2023.
- Yoshihara S, Yanik G, Cooke KR, et al.: Bronchiolitis obliterans syndrome (BOS), bronchiolitis obliterans organizing pneumonia (BOOP), and other late-onset noninfectious pulmonary complications following allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 13 (7): 749-59, 2007.
- Chien JW, Duncan S, Williams KM, et al.: Bronchiolitis obliterans syndrome after allogeneic hematopoietic stem cell transplantation-an increasingly recognized manifestation of chronic graft-versus-host disease. Biol Blood Marrow Transplant 16 (1 Suppl): S106-14, 2010.
- Hildebrandt GC, Fazekas T, Lawitschka A, et al.: Diagnosis and treatment of pulmonary chronic GVHD: report from the consensus conference on clinical practice in chronic GVHD. Bone Marrow Transplant 46 (10): 1283-95, 2011.
- Chien JW, Martin PJ, Gooley TA, et al.: Airflow obstruction after myeloablative allogeneic hematopoietic stem cell transplantation. Am J Respir Crit Care Med 168 (2): 208-14, 2003.
- Cerveri I, Zoia MC, Fulgoni P, et al.: Late pulmonary sequelae after childhood bone marrow transplantation. Thorax 54 (2): 131-5, 1999.
- Uhlving HH, Bang CL, Christensen IJ, et al.: Lung function after allogeneic hematopoietic stem cell transplantation in children: a longitudinal study in a population-based cohort. Biol Blood Marrow Transplant 19 (9): 1348-54, 2013.
- Freudenberger TD, Madtes DK, Curtis JR, et al.: Association between acute and chronic graft-versus-host disease and bronchiolitis obliterans organizing pneumonia in recipients of hematopoietic stem cell transplants. Blood 102 (10): 3822-8, 2003.
- Chien JW, Zhao LP, Hansen JA, et al.: Genetic variation in bactericidal/permeability-increasing protein influences the risk of developing rapid airflow decline after hematopoietic cell transplantation. Blood 107 (5): 2200-7, 2006.
- Hildebrandt GC, Granell M, Urbano-Ispizua A, et al.: Recipient NOD2/CARD15 variants: a novel independent risk factor for the development of bronchiolitis obliterans after allogeneic stem cell transplantation. Biol Blood Marrow Transplant 14 (1): 67-74, 2008.
- Cooke KR, Yanik G: Lung injury following hematopoietic stem cell transplantation. In: Appelbaum FR, Forman SJ, Negrin RS, et al., eds.: Thomas' Hematopoietic Cell Transplantation: Stem Cell Transplantation. 5th ed. John Wiley & Sons Inc., 2015, pp 1156-69.
- Yanik GA, Mineishi S, Levine JE, et al.: Soluble tumor necrosis factor receptor: enbrel (etanercept) for subacute pulmonary dysfunction following allogeneic stem cell transplantation. Biol Blood Marrow Transplant 18 (7): 1044-54, 2012.
- Norman BC, Jacobsohn DA, Williams KM, et al.: Fluticasone, azithromycin and montelukast therapy in reducing corticosteroid exposure in bronchiolitis obliterans syndrome after allogeneic hematopoietic SCT: a case series of eight patients. Bone Marrow Transplant 46 (10): 1369-73, 2011.
- Ellis MJ, Parikh CR, Inrig JK, et al.: Chronic kidney disease after hematopoietic cell transplantation: a systematic review. Am J Transplant 8 (11): 2378-90, 2008.
- Choi M, Sun CL, Kurian S, et al.: Incidence and predictors of delayed chronic kidney disease in long-term survivors of hematopoietic cell transplantation. Cancer 113 (7): 1580-7, 2008.
- Ando M, Ohashi K, Akiyama H, et al.: Chronic kidney disease in long-term survivors of myeloablative allogeneic haematopoietic cell transplantation: prevalence and risk factors. Nephrol Dial Transplant 25 (1): 278-82, 2010.
- Cohen EP, Piering WF, Kabler-Babbitt C, et al.: End-stage renal disease (ESRD)after bone marrow transplantation: poor survival compar ed to other causes of ESRD. Nephron 79 (4): 408-12, 1998.
- Cohen EP, Irving AA, Drobyski WR, et al.: Captopril to mitigate chronic renal failure after hematopoietic stem cell transplantation: a randomized controlled trial. Int J Radiat Oncol Biol Phys 70 (5): 1546-51, 2008.
- Wilson IB, Cleary PD: Linking clinical variables with health-related quality of life. A conceptual model of patient outcomes. JAMA 273 (1): 59-65, 1995.
- Eisen M, Donald CA, Ware JE, et al.: Conceptualization and Measurement of Health for Children in the Health Insurance Study. Rand Corporation, 1980.
- Parsons SK, Barlow SE, Levy SL, et al.: Health-related quality of life in pediatric bone marrow transplant survivors: according to whom? Int J Cancer Suppl 12: 46-51, 1999.
- Barrera M, Atenafu E, Hancock K: Longitudinal health-related quality of life outcomes and related factors after pediatric SCT. Bone Marrow Transplant 44 (4): 249-56, 2009.
- Parsons SK, Shih MC, Duhamel KN, et al.: Maternal perspectives on children's health-related quality of life during the first year after pediatric hematopoietic stem cell transplant. J Pediatr Psychol 31 (10): 1100-15, 2006 Nov-Dec.
- Barrera M, Boyd-Pringle LA, Sumbler K, et al.: Quality of life and behavioral adjustment after pediatric bone marrow transplantation. Bone Marrow Transplant 26 (4): 427-35, 2000.
- Jobe-Shields L, Alderfer MA, Barrera M, et al.: Parental depression and family environment predict distress in children before stem cell transplantation. J Dev Behav Pediatr 30 (2): 140-6, 2009.
- Vrijmoet-Wiersma CM, Kolk AM, Grootenhuis MA, et al.: Child and parental adaptation to pediatric stem cell transplantation. Support Care Cancer 17 (6): 707-14, 2009.
- Felder-Puig R, di Gallo A, Waldenmair M, et al.: Health-related quality of life of pediatric patients receiving allogeneic stem cell or bone marrow transplantation: results of a longitudinal, multi-center study. Bone Marrow Transplant 38 (2): 119-26, 2006.
- Parsons SK, Ratichek SJ, Rodday AM: Caring for the caregiver: eHealth interventions for parents of pediatric hematopoietic stem cell transplant recipients. [Abstract] Pediatr Blood Cancer 56 (7): 1157, 2011.
- Brice L, Weiss R, Wei Y, et al.: Health-related quality of life (HRQoL): the impact of medical and demographic variables upon pediatric recipients of hematopoietic stem cell transplantation. Pediatr Blood Cancer 57 (7): 1179-85, 2011.
- Kaplan SH, Barlow S, Spetter D: Assessing functional status and health-related quality of life among school-aged children: reliability and validity of a new self-reported measure. [Abstract] Qual Life Res 4 (5): 444-45, 1995.
- Barrera M, Atenafu E, Doyle J, et al.: Differences in mothers' and fathers' health-related quality of life after pediatric SCT: a longitudinal study. Bone Marrow Transplant 47 (6): 855-9, 2012.
- Feichtl RE, Rosenfeld B, Tallamy B, et al.: Concordance of quality of life assessments following pediatric hematopoietic stem cell transplantation. Psychooncology 19 (7): 710-7, 2010.
- Löf CM, Winiarski J, Giesecke A, et al.: Health-related quality of life in adult survivors after paediatric allo-SCT. Bone Marrow Transplant 43 (6): 461-8, 2009.
- Sanders JE, Hoffmeister PA, Storer BE, et al.: The quality of life of adult survivors of childhood hematopoietic cell transplant. Bone Marrow Transplant 45 (4): 746-54, 2010.
- Duell T, van Lint MT, Ljungman P, et al.: Health and functional status of long-term survivors of bone marrow transplantation. EBMT Working Party on Late Effects and EULEP Study Group on Late Effects. European Group for Blood and Marrow Transplantation. Ann Intern Med 126 (3): 184-92, 1997.
- Schmidt GM, Niland JC, Forman SJ, et al.: Extended follow-up in 212 long-term allogeneic bone marrow transplant survivors. Issues of quality of life. Transplantation 55 (3): 551-7, 1993.
- Helder DI, Bakker B, de Heer P, et al.: Quality of life in adults following bone marrow transplantation during childhood. Bone Marrow Transplant 33 (3): 329-36, 2004.
- Michel G, Bordigoni P, Simeoni MC, et al.: Health status and quality of life in long-term survivors of childhood leukaemia: the impact of haematopoietic stem cell transplantation. Bone Marrow Transplant 40 (9): 897-904, 2007.
- Ness KK, Bhatia S, Baker KS, et al.: Performance limitations and participation restrictions among childhood cancer survivors treated with hematopoietic stem cell transplantation: the bone marrow transplant survivor study. Arch Pediatr Adolesc Med 159 (8): 706-13, 2005.
- Larsen RL, Barber G, Heise CT, et al.: Exercise assessment of cardiac function in children and young adults before and after bone marrow transplantation. Pediatrics 89 (4 Pt 2): 722-9, 1992.
- Eames GM, Crosson J, Steinberger J, et al.: Cardiovascular function in children following bone marrow transplant: a cross-sectional study. Bone Marrow Transplant 19 (1): 61-6, 1997.
- Hogarty AN, Leahey A, Zhao H, et al.: Longitudinal evaluation of cardiopulmonary performance during exercise after bone marrow transplantation in children. J Pediatr 136 (3): 311-7, 2000.
- Fraser CJ, Bhatia S, Ness K, et al.: Impact of chronic graft-versus-host disease on the health status of hematopoietic cell transplantation survivors: a report from the Bone Marrow Transplant Survivor Study. Blood 108 (8): 2867-73, 2006.
- Rizzo JD, Wingard JR, Tichelli A, et al.: Recommended screening and preventive practices for long-term survivors after hematopoietic cell transplantation: joint recommendations of the European Group for Blood and Marrow Transplantation, Center for International Blood and Marrow Transplant Research, and the American Society for Blood and Marrow Transplantation (EBMT/CIBMTR/ASBMT). Bone Marrow Transplant 37 (3): 249-61, 2006.
- Chow EJ, Anderson L, Baker KS, et al.: Late Effects Surveillance Recommendations among Survivors of Childhood Hematopoietic Cell Transplantation: A Children's Oncology Group Report. Biol Blood Marrow Transplant 22 (5): 782-95, 2016.
- Bunin N, Small T, Szabolcs P, et al.: NCI, NHLBI/PBMTC first international conference on late effects after pediatric hematopoietic cell transplantation: persistent immune deficiency in pediatric transplant survivors. Biol Blood Marrow Transplant 18 (1): 6-15, 2012.
- Dvorak CC, Gracia CR, Sanders JE, et al.: NCI, NHLBI/PBMTC first international conference on late effects after pediatric hematopoietic cell transplantation: endocrine challenges-thyroid dysfunction, growth impairment, bone health, & reproductive risks. Biol Blood Marrow Transplant 17 (12): 1725-38, 2011.
- Parsons SK, Phipps S, Sung L, et al.: NCI, NHLBI/PBMTC First International Conference on Late Effects after Pediatric Hematopoietic Cell Transplantation: health-related quality of life, functional, and neurocognitive outcomes. Biol Blood Marrow Transplant 18 (2): 162-71, 2012.
Actualizaciones más recientes a este resumen (02/23/2024)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Complicaciones graves relacionadas con el trasplante de células madre hematopoyéticas
Se añadió texto para indicar que se cerró un estudio debido a la falta de eficacia, lo que pone en duda la validez del uso profiláctico de la defibrotida (se citó a Grupp et al. como referencia 27).
Se añadió texto para indicar que, aunque no hay ensayos aleatorizados ni prospectivos en los que se haya usado el eculizumab para tratar la microangiopatía trombótica relacionada con el trasplante (TA-TMA), existen datos publicados de estudios retrospectivos institucionales y multicéntricos. En el pasado, la tasa de supervivencia a 1 año para los pacientes con TA-TMA que no recibieron tratamiento fue de alrededor del 20 %. En un estudio de un solo centro se observó una tasa de supervivencia general (SG) a 1 año del 66 % con el tratamiento con eculizumab (se citó a Jodele et al. como referencia 39). También se añadió texto para indicar que en un estudio multicéntrico se notificó una tasa de SG a 6 meses del 47 % con el tratamiento con eculizumab (se citó a Svec et al. como referencia 40).
El Consejo editorial del PDQ sobre el tratamiento pediátrico es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre las complicaciones del trasplante de células madre hematopoyéticas en pediatría, la enfermedad de injerto contra huésped y los efectos tardíos. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El Consejo editorial del PDQ sobre el tratamiento pediátrico, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Complicaciones del trasplante de células madre hematopoyéticas en pediatría, enfermedad de injerto contra huésped y efectos tardíos son:
- Thomas G. Gross, MD, PhD (National Cancer Institute)
- Michael A. Pulsipher, MD (Children's Hospital Los Angeles)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El Consejo editorial del PDQ sobre el tratamiento pediátrico emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento pediátrico. PDQ Complicaciones del trasplante de células madre hematopoyéticas en pediatría, enfermedad de injerto contra huésped y efectos tardíos. Bethesda, MD: National Cancer Institute. Actualización:
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.