Instituto Nacional del Cáncer
Fecha de publicación: Apr 4, 2024
Resumen de información revisada por expertos acerca del tratamiento del cáncer de vías biliares.
Tratamiento del cáncer de vías biliares (colangiocarcinoma)
Información general sobre el cáncer de vías biliares
El cáncer de vías biliares (también llamado colangiocarcinoma y cáncer de conducto biliar) es muy raro. Se desconoce la incidencia real del cáncer de vías biliares porque es difícil determinar un diagnóstico exacto.
Tradicionalmente, los tumores ubicados en las vías biliares dentro del hígado se clasificaban junto con el carcinoma hepatocelular, como tumores primarios de hígado. En cambio, los tumores ubicados en las vías biliares fuera del hígado se clasificaban junto con el cáncer de vesícula biliar, como tumores biliares extrahepáticos. La clasificación de los tumores de vías biliares ha cambiado y ahora incluye los tumores de vías biliares intrahepáticas y extrahepáticas (perihiliares y distales).
Alrededor del 50 % de los colangiocarcinomas surgen en la región perihiliar de las vías biliares, el 40 % en la región distal y el 10 % en la región intrahepática.
Muchos cánceres de vías biliares son multifocales. En la mayoría de los pacientes, no es posible la extirpación quirúrgica completa del tumor y la enfermedad es incurable. Las medidas paliativas como la resección, la radioterapia (por ejemplo, braquiterapia o radioterapia de haz externo) o los procedimientos de colocación de endoprótesis tal vez ayuden a mantener un drenaje biliar adecuado y permitan mejorar la calidad de vida.
Características anatómicas
El sistema biliar está formado por las vías biliares, que es una red de conductos que transportan la bilis desde el hígado hasta el intestino delgado, y su clasificación depende de la ubicación anatómica (Figura 1). El hígado produce la bilis, que es importante para la digestión de las grasas.
Vías biliares intrahepáticas
El conjunto de conductos biliares que están dentro del hígado se llama vías biliares intrahepáticas. Los tumores de vías biliares intrahepáticas se originan en conductillos intrahepáticos pequeños o conductos intrahepáticos grandes que son proximales a la bifurcación de los conductos hepáticos derecho e izquierdo. Estos tumores también se llaman colangiocarcinomas intrahepáticos.
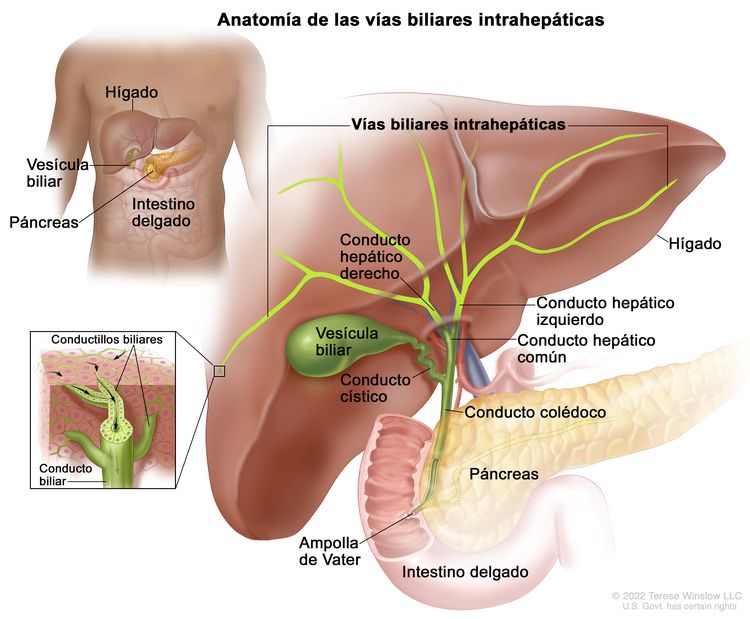 Figure 1. Anatomía de las vías biliares intrahepáticas.
Figure 1. Anatomía de las vías biliares intrahepáticas.
Vías biliares extrahepáticas
El conjunto de conductos biliares que están fuera del hígado se llama vías biliares extrahepáticas. Abarcan la porción de los conductos hepáticos derecho e izquierdo que está fuera del hígado, el conducto hepático común y el conducto colédoco. Las vías biliares extrahepáticas se subdividen en una región perihiliar (hilio) y una región distal.
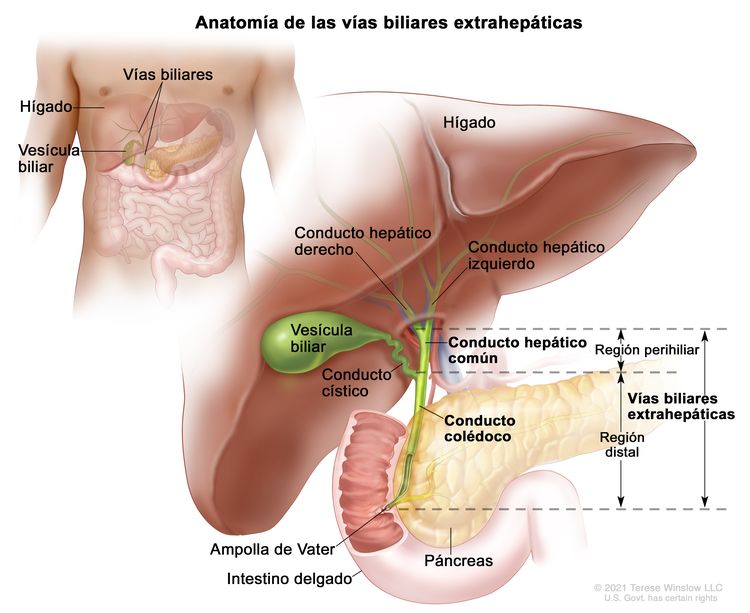 Figure 2. Anatomía de las vías biliares extrahepáticas.
Figure 2. Anatomía de las vías biliares extrahepáticas.
- Región perihiliar (hilio). El hilio es la región de las vías biliares donde los conductos hepáticos derecho e izquierdo salen del hígado y se unen para formar el conducto hepático común que es proximal al origen del conducto cístico. Los tumores en esta región también se llaman colangiocarcinomas perihiliares o tumores de Klatskin.
- Región distal. Esta región de las vías biliares incluye el conducto colédoco que desemboca en el intestino delgado. Los tumores en esta región también se llaman colangiocarcinomas extrahepáticos (Figura 2).
Factores de riesgo
El cáncer de vías biliares se presenta con más frecuencia en pacientes con antecedentes de colangitis esclerosante primaria, colitis ulcerosa crónica, quistes coledocianos o infestaciones por la duela hepática Clonorchis sinensis.
Características clínicas
Los cánceres de las vías biliares perihiliares y distales a menudo producen obstrucción biliar y causan los siguientes síntomas:
- Ictericia.
- Pérdida de peso.
- Dolor abdominal.
- Fiebre.
- Prurito.
El cáncer de vías biliares intrahepáticas a veces es de crecimiento relativamente lento y es difícil distinguirlo clínicamente de los depósitos hepáticos de un adenocarcinoma metastásico.
Evaluación para el diagnóstico y la estadificación
La evaluación clínica depende de pruebas de laboratorio e imágenes radiográficas como las siguientes:
- Pruebas del funcionamiento hepático y otros estudios de laboratorio.
- Ecografía abdominal.
- Tomografía computarizada.
- Imágenes por resonancia magnética.
- Colangiopancreatografía por resonancia magnética.
Estas pruebas permiten observar la extensión del tumor primario y ayudan a determinar la presencia o ausencia de metástasis a distancia.
Si un paciente está en condiciones médicas de someterse a una cirugía y el tumor se puede resecar mediante cirugía, se lleva a cabo una exploración quirúrgica. Se hace un examen patológico de la pieza de resección para establecer la estadificación patológica definitiva.
Pronóstico
El pronóstico depende en parte de la localización anatómica del tumor, que afecta su resecabilidad. Es posible que un tumor de vías biliares sea difícil de resecar por su proximidad a vasos sanguíneos principales y extensión difusa dentro del hígado. La resección total es posible en el 25 % al 30 % de las lesiones que se originan en la vía biliar distal; la tasa de resecabilidad es inferior para las lesiones de sitios más proximales.
La resección completa con márgenes quirúrgicos negativos es la única opción para obtener la cura del cáncer de vías biliares. El compromiso ganglionar y la invasión perineural son factores de pronóstico adverso significativos para los tumores intrahepáticos y extrahepáticos resecables localizados.
Además, en los pacientes con colangiocarcinomas intrahepáticos, los siguientes factores se relacionan con un desenlace más desfavorable:
- Antecedentes personales de colangitis esclerosante primaria.
- Concentración elevada del antígeno de cáncer 19-9.
- Patrón de crecimiento tumoral periductal infiltrante.
- Invasión de las venas hepáticas.
References
- Siegel R, Ma J, Zou Z, et al.: Cancer statistics, 2014. CA Cancer J Clin 64 (1): 9-29, 2014 Jan-Feb.
- de Groen PC, Gores GJ, LaRusso NF, et al.: Biliary tract cancers. N Engl J Med 341 (18): 1368-78, 1999.
- Stain SC, Baer HU, Dennison AR, et al.: Current management of hilar cholangiocarcinoma. Surg Gynecol Obstet 175 (6): 579-88, 1992.
- Wakai T, Shirai Y, Moroda T, et al.: Impact of ductal resection margin status on long-term survival in patients undergoing resection for extrahepatic cholangiocarcinoma. Cancer 103 (6): 1210-6, 2005.
- Klempnauer J, Ridder GJ, von Wasielewski R, et al.: Resectional surgery of hilar cholangiocarcinoma: a multivariate analysis of prognostic factors. J Clin Oncol 15 (3): 947-54, 1997.
- Bhuiya MR, Nimura Y, Kamiya J, et al.: Clinicopathologic studies on perineural invasion of bile duct carcinoma. Ann Surg 215 (4): 344-9, 1992.
- Rosen CB, Nagorney DM, Wiesner RH, et al.: Cholangiocarcinoma complicating primary sclerosing cholangitis. Ann Surg 213 (1): 21-5, 1991.
- Shirabe K, Mano Y, Taketomi A, et al.: Clinicopathological prognostic factors after hepatectomy for patients with mass-forming type intrahepatic cholangiocarcinoma: relevance of the lymphatic invasion index. Ann Surg Oncol 17 (7): 1816-22, 2010.
- Isa T, Kusano T, Shimoji H, et al.: Predictive factors for long-term survival in patients with intrahepatic cholangiocarcinoma. Am J Surg 181 (6): 507-11, 2001.
Clasificación celular del cáncer de vías biliares
intrahepatic bile duct cancerCáncer de vías biliares intrahepáticas
Los tipos histopatológicos más comunes de los tumores de vías biliares intrahepáticas son los siguientes:
- Colangiocarcinoma intrahepático.
- Neoplasia biliar intraepitelial de grado 3 (displasia de grado alto).
- Colangiocarcinoma hepatocelular combinado.
- Carcinosarcoma.
- Neoplasia papilar intraductal con un carcinoma invasivo asociado.
- Neoplasia quística mucinosa con un carcinoma invasivo asociado.
- Carcinoma neuroendocrino.
- Carcinoma neuroendocrino de células grandes.
- Carcinoma neuroendocrino de células pequeñas.
- Neoplasia papilar intraductal con displasia de grado alto.
Cáncer de vías biliares perihiliares
Los adenocarcinomas son el tipo más común de tumores de vías biliares perihiliares. Los tipos histológicos del cáncer de vías biliares perihiliares son los siguientes:
- Carcinoma in situ.
- Neoplasia biliar intraepitelial de grado alto.
- Neoplasia papilar intraductal con displasia de grado alto.
- Neoplasia quística mucinosa con neoplasia intraepitelial de grado alto.
- Adenocarcinoma.
- Adenocarcinoma de tipo biliar.
- Adenocarcinoma de tipo gástrico foveolar.
- Adenocarcinoma de tipo intestinal.
- Adenocarcinoma de células claras.
- Carcinoma mucinoso.
- Carcinoma de células en anillo de sello.
- Carcinoma de células escamosas.
- Carcinoma adenoescamoso.
- Carcinoma indiferenciado.
- Carcinoma neuroendocrino de grado alto.
- Carcinoma neuroendocrino de células pequeñas.
- Neoplasia papilar intraductal con un carcinoma invasivo asociado.
- Neoplasia quística mucinosa con un carcinoma invasivo asociado.
Cáncer de vías biliares distales
Los adenocarcinomas son el tipo más común de tumor de vías biliares distales. Los tipos histológicos de cáncer de vías biliares distales son los siguientes:
- Carcinoma in situ.
- Neoplasia biliar intraepitelial de grado alto.
- Neoplasia papilar intraductal con displasia intraepitelial de grado alto.
- Neoplasia quística mucinosa con neoplasia intraepitelial de grado alto.
- Adenocarcinoma.
- Adenocarcinoma de tipo biliar.
- Adenocarcinoma de tipo intestinal.
- Adenocarcinoma de tipo gástrico foveolar.
- Adenocarcinoma mucinoso.
- Adenocarcinoma de células claras.
- Carcinoma de células en anillo de sello.
- Carcinoma de células escamosas.
- Carcinoma adenoescamoso.
- Carcinoma indiferenciado.
- Carcinoma neuroendocrino de grado alto.
- Carcinoma neuroendocrino de células pequeñas
- Carcinoma adenoneuroendocrino mixto.
- Neoplasia papilar intraductal con un carcinoma invasivo asociado.
- Neoplasia quística mucinosa con un carcinoma invasivo asociado.
References
- Intrahepatic Bile Ducts. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 295–302.
- Perihilar bile ducts. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 311–16.
- Distal bile duct. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 317–25.
Información sobre los estadios del cáncer de vías biliares
Estadificación del cáncer de vías biliares
El cáncer de vías biliares se clasifica como cáncer resecable (localizado) o cáncer irresecable, lo que acarrea una repercusión pronóstica evidente. Se usa el sistema de estadificación TNM (tumor, ganglio linfático y metástasis) para la estadificación del cáncer de vías biliares, por lo general, después de la cirugía y el examen patológico de la pieza extirpada. La evaluación de la extensión de la enfermedad mediante laparotomía es un componente importante de la estadificación.
Sistema de estadificación del AJCC para el cáncer de vías biliares
Sistema de estadificación del AJCC para el cáncer de vías biliares intrahepáticas
El AJCC designó la estadificación según la clasificación TNM para definir el cáncer de vías biliares intrahepáticas.
Los cuadros 1, 2, 3, 4 y 5 incluyen la información sobre los estadios del cáncer de vías biliares intrahepáticas.
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada de AJCC: Intrahepatic Bile Duct. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 295–302. | ||
| 0 | Tis, N0, M0 | Tis = carcinoma in situ (tumor intraductal). |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Descripción | |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Intrahepatic Bile Duct. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 295–302. | |||
| I | IA | T1a, N0, M0 | T1a = tumor solitario ≤5 cm, sin invasión vascular. |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| IB | T1b, N0, M0 | T1b = tumor solitario ≤5 cm, sin invasión vascular. | |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada por el AJCC: Intrahepatic Bile Duct. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 295–302. | ||
| II | T2, N0, M0 | T2 = tumor solitario con invasión vascular intrahepática, o tumores múltiples con invasión vascular o sin esta. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Descripción | |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada por el AJCC: Intrahepatic Bile Duct. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 295–302. | |||
| III | IIIA | T3, N0, M0 | T3 = tumor con perforación del peritoneo visceral. |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| IIIB | T4, N0, M0 | T4 = tumor con compromiso de estructuras extrahepáticas locales por invasión directa. | |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| Cualquier T, N1, M0 | TX = tumor primario no evaluable. | ||
| T0 = sin indicios de tumor primario. | |||
| Tis = carcinoma in situ (tumor intraductal). | |||
| T1 = tumor solitario ≤5 cm o >5 cm, sin invasión vascular. | |||
| –T1a = tumor solitario ≤5 cm, sin invasión vascular. | |||
| –T1b = tumor solitario >5 cm, sin invasión vascular. | |||
| T2 = tumor solitario con invasión vascular intrahepática, o tumores múltiples con invasión vascular o sin esta. | |||
| T3 = tumor con perforación del peritoneo visceral. | |||
| T4 = tumor con compromiso de estructuras extrahepáticas locales por invasión directa. | |||
| N1 = metástasis en ganglio linfático regional. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada por el AJCC: Intrahepatic Bile Duct. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 295–302. | ||
| IV | Cualquier T, cualquier N, M1 | TX = tumor primario no evaluable. |
| T0 = sin indicios de tumor primario. | ||
| Tis = carcinoma in situ (tumor intraductal). | ||
| T1 = tumor solitario ≤5 cm o >5 cm, sin invasión vascular. | ||
| –T1a = tumor solitario ≤5 cm, sin invasión vascular. | ||
| –T1b = tumor solitario >5 cm, sin invasión vascular. | ||
| T2 = tumor solitario con invasión vascular intrahepática, o tumores múltiples con invasión vascular o sin esta. | ||
| T3 = tumor con perforación del peritoneo visceral. | ||
| T4 = tumor con compromiso de estructuras extrahepáticas locales por invasión directa. | ||
| NX = ganglios linfáticos regionales no evaluables. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| N1 = metástasis en ganglio linfático regional. | ||
| M1 = metástasis a distancia. | ||
Sistema de estadificación del AJCC para el cáncer de vías biliares perihiliares
El AJCC designó la estadificación según la clasificación TNM para definir el cáncer de vías biliares perihiliares.
Los cuadros 6, 7, 8, 9 y 10 incluyen la información sobre los estadios de cáncer de vías biliares perihiliares.
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada por el AJCC: Perihilar Bile Ducts. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 311–6. | ||
| 0 | Tis, N0, M0 | Tis = carcinoma in situ o displasia de grado alto. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada por el AJCC: Perihilar Bile Ducts. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 311–6. | ||
| I | T1, N0, M0 | T1 = tumor limitado a la vía biliar con diseminación a la capa muscular o el tejido fibroso. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Descripción |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada por el AJCC: Perihilar Bile Ducts. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 311–6. | ||
| II | T2a–b, N0, M0 | T2 = tumor con invasión que se extiende más allá de la pared de la vía biliar al tejido adiposo circundante, o tumor con invasión al parénquima hepático adyacente. |
| –T2a = tumor con invasión que se extiende más allá de la pared de la vía biliar al tejido adiposo circundante. | ||
| –T2b = tumor con invasión al parénquima hepático adyacente. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Descripción | |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada por el AJCC: Perihilar Bile Ducts. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 311–6. | |||
| III | IIIA | T3, N0, M0 | T3 = tumor con invasión de ramas unilaterales de la vena porta o la arteria hepática. |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| IIIB | T4, N0, M0 | T4 = tumor con invasión de la vena porta principal o sus ramas a nivel bilateral, o de la arteria hepática común; o invasión unilateral de las ramificaciones biliares de segundo orden con compromiso contralateral de la vena porta o de la arteria hepática. | |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| IIIC | Cualquier T, N1, M0 | TX = tumor primario no evaluable. | |
| T0 = sin indicios de tumor primario. | |||
| Tis = carcinoma in situ o displasia de grado alto. | |||
| T1 = tumor limitado a la vía biliar con diseminación a la capa muscular o el tejido fibroso. | |||
| T2 = tumor con invasión que se extiende más allá de la pared de la vía biliar al tejido adiposo circundante, o tumor con invasión al parénquima hepático adyacente. | |||
| –T2a = tumor con invasión que se extiende más allá de la pared de la vía biliar al tejido adiposo circundante. | |||
| –T2b = tumor con invasión al parénquima hepático adyacente. | |||
| T3 = tumor con invasión de ramas unilaterales de la vena porta o la arteria hepática. | |||
| T4 = tumor con invasión de la vena porta principal o sus ramas a nivel bilateral, o de la arteria hepática común; o invasión unilateral de las ramificaciones biliares de segundo orden con compromiso contralateral de la vena porta o de la arteria hepática. | |||
| N1 = compromiso de 1 a 3 ganglios linfáticos, por lo general con compromiso de los ganglios linfáticos hiliares, del conducto cístico, del conducto colédoco, de la arteria hepática, los pancreatoduodenales posteriores y de la vena porta. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Descripción | |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada por el AJCC: Perihilar Bile Ducts. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 311–6. | |||
| IV | IVA | Cualquier T, N2, M0 | TX = tumor primario no evaluable. |
| T0 = sin indicios de tumor primario. | |||
| Tis = carcinoma in situ o displasia de grado alto. | |||
| T1 = tumor limitado a la vía biliar con diseminación a la capa muscular o el tejido fibroso. | |||
| T2 = tumor con invasión que se extiende más allá de la pared de la vía biliar al tejido adiposo circundante, o tumor con invasión al parénquima hepático adyacente. | |||
| –T2a = tumor con invasión que se extiende más allá de la pared de la vía biliar al tejido adiposo circundante. | |||
| –T2b = tumor con invasión al parénquima hepático adyacente. | |||
| T3 = tumor con invasión de ramas unilaterales de la vena porta o la arteria hepática. | |||
| T4 = tumor con invasión de la vena porta principal o sus ramas a nivel bilateral, o de la arteria hepática común; o invasión unilateral de las ramificaciones biliares de segundo orden con compromiso contralateral de la vena porta o de la arteria hepática. | |||
| N2 = compromiso de 4 o más ganglios linfáticos en los sitios descritos para N1. | |||
| M0 = sin metástasis a distancia. | |||
| IVB | Cualquier T, cualquier N, M1 | TX = tumor primario no evaluable. | |
| T0 = sin indicios de tumor primario. | |||
| Tis = carcinoma in situ o displasia de grado alto. | |||
| T1 = tumor limitado a la vía biliar con diseminación a la capa muscular o el tejido fibroso. | |||
| T2 = tumor con invasión que se extiende más allá de la pared de la vía biliar al tejido adiposo circundante, o tumor con invasión al parénquima hepático adyacente. | |||
| –T2a = tumor con invasión que se extiende más allá de la pared a la vía biliar al tejido adiposo circundante. | |||
| –T2b = tumor con invasión al parénquima hepático adyacente. | |||
| T3 = tumor con invasión de ramas unilaterales de la vena porta o la arteria hepática. | |||
| T4 = tumor con invasión de la vena porta principal o sus ramas a nivel bilateral, o de la arteria hepática común; o invasión unilateral de las ramificaciones biliares de segundo orden con compromiso contralateral de la vena porta o de la arteria hepática. | |||
| NX = ganglios linfáticos regionales no evaluables. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| N1 = compromiso de 1 a 3 ganglios linfáticos, por lo general con compromiso de los ganglios linfáticos hiliares, del conducto cístico, del conducto colédoco, de la arteria hepática, los pancreatoduodenales posteriores y de la vena porta. | |||
| N2 = compromiso de 4 o más ganglios linfáticos en los sitios descritos para N1. | |||
| M1 = metástasis a distancia. | |||
Sistema de estadificación del AJCC para el cáncer de vías biliares distales
El AJCC designó la estadificación según la clasificación TNM para definir el cáncer de vías biliares distales. Los estadios definidos en la clasificación TNM se usan para todos los carcinomas primarios que surgen en la vía biliar distal (conducto colédoco) o en el conducto cístico; estos estadios no se usan para los colangiocarcinomas perihiliares o intrahepáticos, los sarcomas, ni los tumores carcinoides.
Los cuadros 11, 12, 13, 14 y 15 incluyen la información sobre los estadios del cáncer de vías biliares distales.
| Estadio | TNM | Definición |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada por el AJCC: Distal Bile Duct. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 317–325. | ||
| 0 | Tis, N0, M0 | Tis = carcinoma in situ o displasia de grado alto. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Definición |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada por el AJCC: Distal Bile Duct. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 317–325. | ||
| I | T1, N0, M0 | T1 = tumor con invasión de la pared de la vía biliar con una profundidad <5 mm. |
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| M0 = sin metástasis a distancia. | ||
| Estadio | TNM | Definición | |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada por el AJCC: Distal Bile Duct. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 317–325. | |||
| II | IIA | T1, N1, M0 | T1 = tumor con invasión de la pared de la vía biliar con una profundidad <5 mm. |
| N1 = metástasis en 1 a 3 ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T2, N0, M0 | Tumor con invasión de la pared de la vía biliar con una profundidad 5–12 mm. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| IIB | T2, N1, M0 | T2 = tumor con invasión de la pared de la vía biliar con una profundidad 5–12 mm. | |
| N1 = metástasis en 1 a 3 ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T3, N0, M0 | T3 = tumor con invasión de la pared de la vía biliar con una profundidad >12 mm. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T3, N1, M0 | T3 = tumor con invasión de la pared de la vía biliar con una profundidad >12 mm. | ||
| N1 = metástasis en 1 a 3 ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Definición | |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada por el AJCC: Distal Bile Duct. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 317–325. | |||
| III | IIIA | T1, N2, M0 | T1 = tumor con invasión de la pared de la vía biliar con una profundidad <5 mm. |
| N2 = metástasis a 4 o más ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T2, N2, M0 | T2 = tumor con invasión de la pared de la vía biliar con una profundidad 5–12 mm. | ||
| N2 = metástasis a 4 o más ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T3, N2, M0 | T3 = tumor con invasión de la pared de la vía biliar con una profundidad >12 mm. | ||
| N2 = metástasis a 4 o más ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| IIIB | T4, N0, M0 | T4 = tumor con compromiso del tronco celiaco, la arteria mesentérica superior o la arteria hepática común. | |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T4, N1, M0 | T4 = tumor con compromiso del tronco celiaco, la arteria mesentérica superior o la arteria hepática común. | ||
| N1 = metástasis en 1 a 3 ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| T4, N2, M0 | T4 = tumor con compromiso del tronco celiaco, la arteria mesentérica superior o la arteria hepática común. | ||
| N2 = metástasis a 4 o más ganglios linfáticos regionales. | |||
| M0 = sin metástasis a distancia. | |||
| Estadio | TNM | Definición |
|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | ||
| aReproducción autorizada por el AJCC: Distal Bile Duct. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 317–325. | ||
| IV | Cualquier T, cualquier N, M1 | TX = tumor primario no evaluable. |
| Tis = carcinoma in situ o displasia de grado alto. | ||
| T1 = tumor con invasión de la pared de la vía biliar con una profundidad <5 mm. | ||
| T2 = tumor con invasión de la pared de la vía biliar con una profundidad 5–12 mm. | ||
| T3 = tumor con invasión de la pared de la vía biliar con una profundidad >12 mm. | ||
| T4 = tumor con compromiso del tronco celiaco, la arteria mesentérica superior o la arteria hepática común. | ||
| NX = ganglios linfáticos regionales no evaluables. | ||
| N0 = sin metástasis en ganglios linfáticos regionales. | ||
| N1 = metástasis en 1 a 3 ganglios linfáticos regionales. | ||
| N2 = metástasis a 4 o más ganglios linfáticos regionales. | ||
| M1 = metástasis a distancia. | ||
References
- Intrahepatic Bile Ducts. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 295–302.
- Perihilar Bile Ducts. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 311–6.
- Distal bile duct. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp. 317–25.
Aspectos generales de las opciones de tratamiento del cáncer de vías biliares
El tratamiento del cáncer de vías biliares depende principalmente de la posibilidad de extirpación completa del tumor.
Cáncer de vías biliares resecable (localizado)
El cáncer de vías biliares localizado (intrahepático o extrahepático) a veces se puede extirpar por completo mediante cirugía. Estos tumores representan muy pocos casos y a menudo están en la porción distal del conducto colédoco. El pronóstico a largo plazo de los pacientes tratados con resección quirúrgica varía según la extensión del tumor primario, el estado de los márgenes, el compromiso ganglionar y otras características patológicas.
Es posible llevar a cabo resecciones extensas de tumores en la bifurcación del conducto hepático (tumores de Klatskin, también conocidos como tumores hiliares) para abarcar el hígado adyacente, ya sea mediante lobectomía o extirpación de los segmentos 4 y 5 del hígado. Si fuera necesaria una resección hepática extensa para lograr la resección completa del cáncer entonces se debe evaluar la reserva hepática posoperatoria. En los pacientes con cirrosis subyacente, se determina la clase Child-Pugh y el puntaje del Model for End-Stage Liver Disease.
Cáncer de vías biliares irresecable (incluye el cáncer metastásico y recidivante)
La mayoría de los cánceres de vías biliares intrahepáticos, perihiliares y distales son irresecables y no es posible extirparlos por completo. A menudo, el cáncer invade en forma directa la vena porta, el hígado adyacente, a lo largo del conducto colédoco y los ganglios linfáticos adyacentes. Es posible que la hipertensión portal sea el resultado de la invasión de la vena porta. La diseminación a partes distantes del cuerpo es poco común, pero a veces se producen metástasis intraabdominales; en especial, metástasis peritoneales. También se presentan metástasis hepáticas hematógenas y transperitoneales en el cáncer de vías biliares de cualquier sitio. Por otra parte, la mayoría de los pacientes que se someten a resección presentarán una enfermedad recidivante dentro del sistema hepatobiliar o, con menos frecuencia, en sitios distantes.
En ensayos de fase II se ha estudiado el uso de quimiorradioterapia para la enfermedad en estadio local avanzado con el fin de mejorar el control local y posiblemente lograr la reclasificación a un estadio más bajo. Estos abordajes no se han comparado con el tratamiento estándar y no se conoce su potencial para obtener la curación.
La atención de los pacientes con cáncer de vías biliares irresecable tiene fines paliativos.
Las opciones de tratamiento del cáncer de vías biliares se describen en el Cuadro 16.
| Criterios de estadificación | Opciones de tratamiento |
|---|---|
| Cáncer de vías biliares resecable (localizado) | Cirugía |
| Terapia adyuvante | |
| Cáncer de vías biliares irresecable (incluye el cáncer metastásico y recidivante) | Terapia paliativa |
| Quimioterapia | |
| Inmunoterapia | |
| Terapia dirigida |
Administración de capecitabina y fluorouracilo
El gen de la dihidropirimidina–deshidrogenasa (DPYD), codifica la enzima que cataboliza las pirimidinas y las fluoropirimidinas, como la capecitabina y el fluorouracilo. Se estima que entre el 1 % y el 2 % de la población tiene variantes defectuosas de la enzima dihidropirimidina–deshidrogenasa DPYD que produce la reducción de la función de la proteína DPD y la acumulación de pirimidinas y fluoropirimidinas en el cuerpo. Los pacientes con la variante DPYD*2A que reciben fluoropirimidinas quizás presenten efectos tóxicos graves que ponen en riesgo la salud, y a veces son mortales. Se han identificado muchas otras variantes de DPYD, con diferentes efectos clínicos. Es posible que se recomiende evitar la fluoropirimidina o reducir la dosis al 50 % según el genotipo DPYD del paciente y el número de alelos funcionales de DPYD. Las pruebas genéticas para DPYD cuestan menos de $200, pero la cobertura del seguro varía debido a la falta de directrices nacionales. Además, es posible que las pruebas retrasen el tratamiento por 2 semanas, lo que no sería aconsejable en casos de urgencia. Este tema es objeto de controversia y requiere evaluación adicional.
References
- Nagorney DM, Donohue JH, Farnell MB, et al.: Outcomes after curative resections of cholangiocarcinoma. Arch Surg 128 (8): 871-7; discussion 877-9, 1993.
- Washburn WK, Lewis WD, Jenkins RL: Aggressive surgical resection for cholangiocarcinoma. Arch Surg 130 (3): 270-6, 1995.
- Edeline J, Touchefeu Y, Guiu B, et al.: Radioembolization Plus Chemotherapy for First-line Treatment of Locally Advanced Intrahepatic Cholangiocarcinoma: A Phase 2 Clinical Trial. JAMA Oncol 6 (1): 51-59, 2020.
- Cercek A, Boerner T, Tan BR, et al.: Assessment of Hepatic Arterial Infusion of Floxuridine in Combination With Systemic Gemcitabine and Oxaliplatin in Patients With Unresectable Intrahepatic Cholangiocarcinoma: A Phase 2 Clinical Trial. JAMA Oncol 6 (1): 60-67, 2020.
- Sharma BB, Rai K, Blunt H, et al.: Pathogenic DPYD Variants and Treatment-Related Mortality in Patients Receiving Fluoropyrimidine Chemotherapy: A Systematic Review and Meta-Analysis. Oncologist 26 (12): 1008-1016, 2021.
- Lam SW, Guchelaar HJ, Boven E: The role of pharmacogenetics in capecitabine efficacy and toxicity. Cancer Treat Rev 50: 9-22, 2016.
- Shakeel F, Fang F, Kwon JW, et al.: Patients carrying DPYD variant alleles have increased risk of severe toxicity and related treatment modifications during fluoropyrimidine chemotherapy. Pharmacogenomics 22 (3): 145-155, 2021.
- Amstutz U, Henricks LM, Offer SM, et al.: Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for Dihydropyrimidine Dehydrogenase Genotype and Fluoropyrimidine Dosing: 2017 Update. Clin Pharmacol Ther 103 (2): 210-216, 2018.
- Henricks LM, Lunenburg CATC, de Man FM, et al.: DPYD genotype-guided dose individualisation of fluoropyrimidine therapy in patients with cancer: a prospective safety analysis. Lancet Oncol 19 (11): 1459-1467, 2018.
- Lau-Min KS, Varughese LA, Nelson MN, et al.: Preemptive pharmacogenetic testing to guide chemotherapy dosing in patients with gastrointestinal malignancies: a qualitative study of barriers to implementation. BMC Cancer 22 (1): 47, 2022.
- Brooks GA, Tapp S, Daly AT, et al.: Cost-effectiveness of DPYD Genotyping Prior to Fluoropyrimidine-based Adjuvant Chemotherapy for Colon Cancer. Clin Colorectal Cancer 21 (3): e189-e195, 2022.
- Baker SD, Bates SE, Brooks GA, et al.: DPYD Testing: Time to Put Patient Safety First. J Clin Oncol 41 (15): 2701-2705, 2023.
Tratamiento del cáncer de vías biliares resecable (localizado)
Opciones de tratamiento del cáncer de vías biliares resecable (localizado)
Las opciones de tratamiento del cáncer de vías biliares resecable (localizado) son las siguientes:
- Cirugía.
- Terapia adyuvante.
Cirugía
Cáncer de vías biliares intrahepáticas
La resección hepática con el fin de obtener márgenes sin compromiso tumoral tiene potencial curativo para los canceres de vías biliares intrahepáticas. Si fuera necesaria una resección grande del hígado para obtener márgenes sin compromiso tumoral, se puede contemplar una embolización preoperatoria de la vena porta para aumentar el volumen del hígado remanente.
La resección parcial del hígado o la hepatectomía parcial para obtener márgenes sin compromiso tumoral es un procedimiento cuyo objetivo es la curación de los pacientes con colangiocarcinoma intrahepático. El alcance de la resección hepática necesaria depende de la extensión del compromiso del parénquima hepático y la proximidad del tumor a los vasos sanguíneos grandes de esta región.
No está clara la función de la linfadenectomía portal de rutina ya que acarrea un riesgo de desvascularización del conducto colédoco.
Cáncer de vías biliares perihiliares
En los casos de colangiocarcinoma perihiliar (tumor de Klatskin), la resección de la vía biliar sola conduce a tasas altas de recidiva local debido a la confluencia inmediata de los conductos hepáticos y el lóbulo caudado. La adición de una hepatectomía parcial que incluya el lóbulo caudado mejora los desenlaces a largo plazo, pero también acarrea un aumento de las complicaciones posoperatorias. Con este abordaje quirúrgico radical, se notificaron tasas de supervivencia a 5 años del 20 % al 50 %. El conocimiento de las características anatómicas vasculares y ductales del hilio hepático normal, así como de sus variaciones ha aumentado el número de tumores en la bifurcación de los conductos hepáticos que se pueden extirpar.
Aunque el sitio primario de recaída después de la resección quirúrgica es local, con frecuencia se ha notificado recidiva a distancia.
El procedimiento quirúrgico óptimo para el carcinoma de vías biliares perihiliares varía según la ubicación del tumor en el árbol biliar, la extensión del compromiso del parénquima hepático y la proximidad del tumor a los vasos sanguíneos grandes de esta región. Se deberá evaluar el estado de los ganglios linfáticos regionales en el momento de la cirugía debido a su importancia pronóstica. Las operaciones para el cáncer de vías biliares por lo general son extensas . En una cohorte histórica se notificó una tasa de mortalidad operatoria de alrededor del 10 %, y casi del 40 % de riesgo de recidiva de la enfermedad.
En pacientes con ictericia, hay polémica sobre el uso de un drenaje percutáneo con catéter transhepático o la colocación endoscópica de una endoprótesis para aliviar la obstrucción biliar debido a la falta de uniformidad en los beneficios clínicos significativos y la preocupación por un riesgo más alto de complicaciones posoperatorias. No obstante, en pacientes con ictericia, se deberá considerar el drenaje percutáneo con un catéter transhepático o la colocación endoscópica de una endoprótesis para aliviar la obstrucción biliar antes de la cirugía; en especial, si la ictericia es grave o si hay algún elemento de azoemia.
Cáncer de vías biliares distales
La resección completa con márgenes quirúrgicos negativos es la única opción para obtener la cura del cáncer de vías biliares distales. Los tumores de vías biliares son difíciles de resecar por su proximidad a vasos sanguíneos principales y la infiltración difusa en la vías biliares adyacentes. La resección total es posible en el 25 % al 30 % de las lesiones que se originan en la vía biliar distal; la tasa de resecabilidad es inferior para las lesiones de sitios más proximales.
El procedimiento quirúrgico óptimo para el carcinoma de vías biliares distales varía según la ubicación en el árbol biliar, el grado de compromiso del parénquima hepático y la proximidad del tumor a los vasos sanguíneos grandes de esta región. Se examinan los ganglios linfáticos regionales en el momento de la cirugía debido a su importancia pronóstica. En el caso de pacientes con cáncer que presentan compromiso en el extremo inferior de la vía y en los ganglios linfáticos regionales es posible que se necesite una resección extensa (procedimiento de Whipple). Los desenlaces de supervivencia a 5 años oscilan entre el 20 % y el 50 %. Las operaciones de derivación o colocación de endoprótesis endoluminales son posibles alternativas cuando se determina que el tumor es irresecable durante la cirugía.
En pacientes con ictericia, hay polémica sobre el uso de un drenaje percutáneo con catéter transhepático o la colocación endoscópica de una endoprótesis para aliviar la obstrucción biliar, pero estas opciones a veces se consideran antes de la cirugía; en especial, si la ictericia es grave o si hay algún elemento de azoemia.
Terapia adyuvante
Quimioterapia
En numerosas series retrospectivas se indicó que es posible que la quimioterapia adyuvante tras una resección quirúrgica completa sea beneficiosa.[Nivel de evidencia C2] Sin embargo, no se ha logrado demostrar, de forma homogénea, un beneficio significativo para la supervivencia general (SG) en ensayos prospectivos aleatorizados.
Evidencia (quimioterapia):
- En un estudio multicéntrico de fase III del Reino Unido (BILCAP) participaron 447 pacientes con colangiocarcinoma o cáncer de vesícula biliar con invasión muscular sometidos a resección macroscópica completa con intención curativa. Los pacientes se asignaron al azar para recibir 8 ciclos de capecitabina (1250 mg/m2 2 veces al día en los días 1−14 de un ciclo de 21 días) u observación.[Nivel de evidencia B1] Al cabo de una mediana de seguimiento de 106 meses, se observaron los siguientes resultados:
- No se encontró una diferencia estadísticamente significativa en la SG en el análisis por intención de tratar (mediana de SG, 49,6 meses en el grupo de capecitabina vs. 36,1 meses en el grupo de observación; cociente de riesgos instantáneos [CRI], 0,84; intervalo de confianza [IC] 95 %, 0,67−1,06; P > 0,05).
- En el análisis por intensión de tratar la mediana de supervivencia sin recidiva (SSR) fue de 24,3 meses (IC 95 %, 18,6–34,6) en el grupo de capecitabina y de 17,4 meses (IC 95 % 11,8–23) en el grupo de observación. En un modelo de riesgos instantáneos proporcionales de Cox se indica el potencial de mejora de la SSR en los primeros 24 meses de aleatorización (CRI, 0,74; IC 95 %, 0,57–0,96), pero sin diferencia significativa en el periodo después de 24 meses (CRI, 1,57; IC 95 %, 0,90–2,74).
- En el estudio sin enmascaramiento y aleatorizado de fase II, STAMP (NCT03079427), presentado en forma de resumen, participaron 101 pacientes con cáncer de vías biliares perihiliares o distales, al menos una metástasis ganglionar regional (N1 o mayor), y resección macroscópica completa (R0 o R1) en un plazo de 12 semanas. Los pacientes se asignaron para recibir 8 ciclos de capecitabina (1250 mg/m2) 2 veces al día en los días 1–14 de un ciclo de 21 días (basado en el ensayo BILCAP) u 8 ciclos de cisplatino (25 mg/m2) y gemcitabina (1,000 mg/m2) en los días 1 y 8 de un ciclo de 21 días.[Nivel de evidencia B1] Al cabo de una mediana de seguimiento de 28,7 meses, se observaron los siguientes resultados:
- La mediana de supervivencia sin enfermedad (SSE), el criterio principal de valoración, fue de 14,3 meses (IC unilateral 90 %, 10,7–16,5) en el grupo de cisplatino y gemcitabina y de 11,1 meses en el grupo de capecitabina (IC unilateral 90 %, 8,4–12,7).
- La mediana de SG fue de 35,7 meses (IC unilateral 90 %, 29,5–no estimado) en el grupo de cisplatino y gemcitabina y de 35,7 meses (IC unilateral 90 %, 30,9–no estimado) en el grupo de capecitabina.
- En el grupo de gemcitabina y cisplatino hubo aumento en las tasas de toxicidad. Se presentaron eventos adversos de grados 3 a 4 en el 84 % de los pacientes que recibieron gemcitabina y cisplatino (la neutropenia fue el más común) y en el 16 % de los pacientes que recibieron capecitabina (el síndrome mano-pie fue el más común).
- Debido a la ausencia de diferencia significativa en la SSE y la SG, y la tasa de toxicidad alta en el grupo de cisplatino con gemcitabina, la capecitabina continúa siendo el estándar de referencia actual para la terapia adyuvante.
- En un estudio multicéntrico francés de fase III (PRODIGE 12-ACCORD 18-UNICANCER GI), se asignó al azar a 196 pacientes sometidos a resección R0 o R1 por un cáncer biliar a recibir 12 ciclos de gemcitabina y oxaliplatino (GEMOX) o someterse a vigilancia.[Nivel de evidencia B1] Después de una mediana de seguimiento de 46,5 meses, se observaron los siguientes resultados:
- No hubo diferencia estadísticamente significativa en el resultado principal de SSR (mediana, 30,4 meses con GEMOX vs. 18,5 meses con observación; CRI, 0,88; IC 95 %, 0,62–1,25, P = 0,48).
- No hubo diferencia estadísticamente significativa en el resultado secundario de SG (75,8 meses con GEMOX vs. 50,8 meses con observación; CRI, 1,08; IC 95 %, 0,7–1,66; P = 0,74).
- El Bile Duct Cancer Adjuvant Trial (BCAT), es un estudio multicéntrico japonés de fase III en el que un grupo de 225 pacientes con cáncer de vías biliares extirpado se asignó al azar a recibir 6 ciclos de gemcitabina adyuvante u observación.[Nivel de evidencia B1]
- No hubo diferencia significativa en el criterio principal de valoración de la SG (mediana, 62,3 meses con gemcitabina vs. 63,8 meses con observación; CRI, 1,01; IC 95 %, 0,7–1,45; P = 0,964).
- No se observó diferencia en la SG, incluso en los subgrupos estratificados por estado de ganglios linfáticos y estado de márgenes quirúrgicos.
- Tampoco se observaron diferencias significativas en el resultado secundario de SSR (mediana, 36 meses con gemcitabina vs. 39,9 meses con observación; CRI, 0,93; P = 0,693).
- En el ensayo European Study Group for Pancreatic Cancer (ESPAC-3 [NCT00058201]), se asignó al azar a 428 pacientes con cáncer periampular (entre estos, 96 pacientes de cáncer de vías biliares), a someterse a observación, 6 meses de fluorouracilo (5-FU) y leucovorina, o 6 meses de gemcitabina.[Nivel de evidencia B1]
- Al comparar la quimioterapia adyuvante con la observación sola en todos los pacientes, no hubo un beneficio significativo para la SG. No obstante, después de un ajuste por las variables pronósticas en el análisis multivariante, se estableció un vínculo estadísticamente significativo de beneficio para la SG en el grupo de quimioterapia adyuvante (CRI, 0,75; IC 95 %, 0,57–0,98; P = 0,03).
- En un análisis previsto del subgrupo de 96 pacientes con cáncer de vías biliares, no se observó beneficio en los pacientes tratados con quimioterapia. Las limitaciones de este análisis de subgrupo incluyen una potencia estadística limitada y la dificultad para distinguir el sitio de origen patológico de los tumores ampulares o distales del conducto colédoco.
- La mediana de supervivencia fue de 27 meses en el grupo de observación sola, 18 meses en el grupo de 5-FU y leucovorina, y de 20 meses en el grupo de gemcitabina sola.
- En un estudio japonés multiinstitucional, se comparó la cirugía sola con mitomicina e infusión de 5-FU seguidos de 5-FU hasta la progresión de la enfermedad.[Nivel de evidencia B1]
- En el subconjunto de pacientes con cáncer de vías biliares (n = 139), no se observó un beneficio para la supervivencia.
Para obtener una lista de los regímenes quimioterapéuticos con posible actividad, consultar la sección Tratamiento del cáncer de vías biliares irresecable (incluye el cáncer metastásico y recidivante).
Radioterapia de haz externo
En numerosos estudios retrospectivos se indicó que la quimioterapia adyuvante tras una resección quirúrgica completa quizás sea beneficiosa.[Nivel de evidencia A1] No obstante, en ningún ensayo prospectivo aleatorizado se demostró un beneficio para la SG.
Evidencia (radioterapia de haz externo):
- En un pequeño ensayo aleatorizado con 204 pacientes de cánceres pancreáticos y periampulares no se demostró un beneficio de supervivencia con la adición de quimiorradioterapia después de la cirugía. Este estudio es limitado porque solo pocos pacientes tenían un diagnóstico de cáncer de vías biliares y el 20 % de los pacientes asignados al azar a recibir quimiorradioterapia no recibieron tratamiento.[Nivel de evidencia C3]
- En un ensayo de fase II de un grupo cooperativo, SWOG S0809 (NCT00789958), se evaluó el uso de capecitabina y gemcitabina adyuvantes seguido de quimiorradioterapia para el colangiocarcinoma extrahepático y el cáncer de vesícula biliar resecado. Se inscribieron 79 pacientes aptos con enfermedad pT2 a pT4, compromiso ganglionar o márgenes de resección positivos (cáncer de vías biliares extrahepáticas, n = 54; cáncer de vesícula biliar, n = 25).[Nivel de evidencia C2]
- La tasa de supervivencia a 2 años del 65 % fue significativamente más alta que la esperada, según los controles históricos.[Nivel de evidencia C2]
- Se observó toxicidad de grado 3 en el 52 % de los pacientes y de grado 4 en el 11 % de los pacientes.
- A partir de estos resultados, se observó que el régimen fue bien tolerado, pero que requiere comprobación en un ensayo controlado aleatorizado.
Se alienta la participación de todos los pacientes en ensayos clínicos de terapias adyuvantes. Para obtener más información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
References
- Dodson RM, Weiss MJ, Cosgrove D, et al.: Intrahepatic cholangiocarcinoma: management options and emerging therapies. J Am Coll Surg 217 (4): 736-750.e4, 2013.
- Burke EC, Jarnagin WR, Hochwald SN, et al.: Hilar Cholangiocarcinoma: patterns of spread, the importance of hepatic resection for curative operation, and a presurgical clinical staging system. Ann Surg 228 (3): 385-94, 1998.
- Nakeeb A, Tran KQ, Black MJ, et al.: Improved survival in resected biliary malignancies. Surgery 132 (4): 555-63; discussion 563-4, 2002.
- Hasegawa S, Ikai I, Fujii H, et al.: Surgical resection of hilar cholangiocarcinoma: analysis of survival and postoperative complications. World J Surg 31 (6): 1256-63, 2007.
- Loehrer AP, House MG, Nakeeb A, et al.: Cholangiocarcinoma: are North American surgical outcomes optimal? J Am Coll Surg 216 (2): 192-200, 2013.
- Liu F, Li Y, Wei Y, et al.: Preoperative biliary drainage before resection for hilar cholangiocarcinoma: whether or not? A systematic review. Dig Dis Sci 56 (3): 663-72, 2011.
- Nimura Y: Preoperative biliary drainage before resection for cholangiocarcinoma (Pro). HPB (Oxford) 10 (2): 130-3, 2008.
- Laurent A, Tayar C, Cherqui D: Cholangiocarcinoma: preoperative biliary drainage (Con). HPB (Oxford) 10 (2): 126-9, 2008.
- Stain SC, Baer HU, Dennison AR, et al.: Current management of hilar cholangiocarcinoma. Surg Gynecol Obstet 175 (6): 579-88, 1992.
- Fong Y, Blumgart LH, Lin E, et al.: Outcome of treatment for distal bile duct cancer. Br J Surg 83 (12): 1712-5, 1996.
- Bortolasi L, Burgart LJ, Tsiotos GG, et al.: Adenocarcinoma of the distal bile duct. A clinicopathologic outcome analysis after curative resection. Dig Surg 17 (1): 36-41, 2000.
- Murakami Y, Uemura K, Sudo T, et al.: Adjuvant gemcitabine plus S-1 chemotherapy improves survival after aggressive surgical resection for advanced biliary carcinoma. Ann Surg 250 (6): 950-6, 2009.
- Bridgewater J, Fletcher P, Palmer DH, et al.: Long-Term Outcomes and Exploratory Analyses of the Randomized Phase III BILCAP Study. J Clin Oncol 40 (18): 2048-2057, 2022.
- Yoo C, Jeong H, Kim K, et al.: Adjuvant gemcitabine plus cisplatin (GemCis) versus capecitabine (CAP) in patients (pts) with resected lymph node (LN)-positive extrahepatic cholangiocarcinoma (CCA): A multicenter, open-label, randomized, phase 2 study (STAMP). [Abstract] J Clin Oncol 40 (Suppl 16): A-4019, 2022.
- Edeline J, Benabdelghani M, Bertaut A, et al.: Gemcitabine and Oxaliplatin Chemotherapy or Surveillance in Resected Biliary Tract Cancer (PRODIGE 12-ACCORD 18-UNICANCER GI): A Randomized Phase III Study. J Clin Oncol 37 (8): 658-667, 2019.
- Ebata T, Hirano S, Konishi M, et al.: Randomized clinical trial of adjuvant gemcitabine chemotherapy versus observation in resected bile duct cancer. Br J Surg 105 (3): 192-202, 2018.
- Neoptolemos JP, Moore MJ, Cox TF, et al.: Effect of adjuvant chemotherapy with fluorouracil plus folinic acid or gemcitabine vs observation on survival in patients with resected periampullary adenocarcinoma: the ESPAC-3 periampullary cancer randomized trial. JAMA 308 (2): 147-56, 2012.
- Takada T, Amano H, Yasuda H, et al.: Is postoperative adjuvant chemotherapy useful for gallbladder carcinoma? A phase III multicenter prospective randomized controlled trial in patients with resected pancreaticobiliary carcinoma. Cancer 95 (8): 1685-95, 2002.
- Kim TH, Han SS, Park SJ, et al.: Role of adjuvant chemoradiotherapy for resected extrahepatic biliary tract cancer. Int J Radiat Oncol Biol Phys 81 (5): e853-9, 2011.
- Hughes MA, Frassica DA, Yeo CJ, et al.: Adjuvant concurrent chemoradiation for adenocarcinoma of the distal common bile duct. Int J Radiat Oncol Biol Phys 68 (1): 178-82, 2007.
- Klinkenbijl JH, Jeekel J, Sahmoud T, et al.: Adjuvant radiotherapy and 5-fluorouracil after curative resection of cancer of the pancreas and periampullary region: phase III trial of the EORTC gastrointestinal tract cancer cooperative group. Ann Surg 230 (6): 776-82; discussion 782-4, 1999.
- Ben-Josef E, Guthrie KA, El-Khoueiry AB, et al.: SWOG S0809: A Phase II Intergroup Trial of Adjuvant Capecitabine and Gemcitabine Followed by Radiotherapy and Concurrent Capecitabine in Extrahepatic Cholangiocarcinoma and Gallbladder Carcinoma. J Clin Oncol 33 (24): 2617-22, 2015.
Tratamiento del cáncer de vías biliares irresecable (incluye el cáncer metastásico y recidivante)
Opciones de tratamiento para el cáncer de vías biliares irresecable (incluye el cáncer metastásico y recidivante)
Las opciones de tratamiento para el cáncer de vías biliares irresecable (incluye el cáncer metastásico y recidivante) son las siguientes:
- Terapia paliativa.
- Quimioterapia.
- Inmunoterapia.
- Terapia dirigida.
Terapia paliativa
Se justifica el alivio de la obstrucción biliar cuando síntomas como el prurito y la disfunción hepática sobrepasan otros síntomas del cáncer. Cuando sea posible, esta paliación se logra al colocar una endoprótesis en las vías biliares mediante técnicas quirúrgicas, endoscópicas o percutáneas.
La radioterapia paliativa quizás sea benéfica, y es posible que los pacientes sean aptos para recibir radioterapia corporal estereotáctica y embolización intraarterial.
Quimioterapia
La quimioterapia sistémica es apropiada para determinados pacientes con estado funcional adecuado y funcionamiento orgánico pleno. En una minoría de pacientes se notificaron remisiones parciales transitorias con el uso de los siguientes fármacos:
- Fluoropirimidinas (gemcitabina).
- Derivados del platino.
- Docetaxel.
Evidencia (quimioterapia):
- En un estudio de fase III (NCT00262769) se asignó al azar a 410 pacientes con carcinoma biliar irresecable, recidivante o metastásico para que recibieran cisplatino seguido de gemcitabina, o gemcitabina sola por hasta 6 meses. Se observaron los siguientes resultados:[Nivel de evidencia A1]
- La mediana de supervivencia general (SG) mejoró entre los pacientes tratados con cisplatino y gemcitabina (11,7 meses) en comparación con los pacientes tratados con gemcitabina sola (8,1 meses), (cociente de riesgos instantáneos [CRI], 0,64; intervalo de confianza [IC] 95 %, 0,52−0,80; P< 0,001).
- Se demostró un beneficio similar para la mediana de SG en todos los subgrupos, incluso en 73 pacientes de cáncer de vías biliares extrahepáticas y 57 pacientes con tumores hiliares.
- La toxicidad de grados 3 y 4 fue similar en ambos grupos del estudio, a excepción del aumento de toxicidad hematológica en los pacientes asignados al azar al grupo de gemcitabina y cisplatino, además del aumento de toxicidad hepática en los pacientes asignados al azar al grupo de gemcitabina en monoterapia.
- En un estudio de ausencia de inferioridad de fase III (NCT01470443) se inscribieron 114 pacientes con cánceres biliares metastásicos, entre ellos 30 (26 %) con cáncer primario de vesícula biliar. Los pacientes se asignaron al azar a recibir capecitabina con oxaliplatino (XELOX) o gemcitabina con oxaliplatino (GEMOX).[Nivel de evidencia B1]
- La SG no fue significativamente diferente, 10,4 meses (IC 95 %, 8,0−12,6 meses) en el grupo de GEMOX en comparación con 10,6 meses (IC 95 %, 7,3−15,5 meses) en el grupo de XELOX (P = 0,131).
- El resultado primario de supervivencia sin progresión (SSP) a los 6 meses fue del 44,6 % para el grupo de GEMOX y del 46,7 % para el grupo de XELOX (IC 95 % de diferencia en la tasa de SSP a 6 meses, de un -12 % al 16 %, lo que cumple con el criterio de ausencia de inferioridad).
- En un análisis de subgrupos predefinido según el sitio primario de la enfermedad, no se encontró diferencia en la tasa de respuesta objetiva entre los 2 grupos de pacientes con cáncer de vesícula biliar (P = 0,598).
Hasta que se hagan más ensayos clínicos, el uso de cisplatino y gemcitabina se considera la quimioterapia de base estándar de primera línea de referencia para los pacientes con cáncer de vías biliares irresecable, metastásico o recidivante. A partir de los resultados de los ensayos TOPAZ-1 y KEYNOTE-966, la incorporación de un inhibidor de puntos de control (durvalumab o pembrolizumab) a la terapia de primera línea se ha convertido en el tratamiento estándar (para obtener más información, consultar la sección Inmunoterapia). Las posibles alternativas son gemcitabina y capecitabina, GEMOX y XELOX. La participación en ensayos clínicos se debe considerar para todos los pacientes.
Hay escasa evidencia de buena calidad que sirva para guiar la selección de un régimen de segunda línea en la enfermedad resistente al tratamiento:
- En un ensayo multicéntrico de fase III en el Reino Unido (ABC-06 [NCT01926236]), se asignaron al azar 162 pacientes con cáncer biliar localmente avanzado o metastásico y progresión de la enfermedad documentada mediante radiografías durante el tratamiento de primera línea con cisplatino y gemcitabina, para recibir FOLFOX (ácido folínico, fluorouracilo [5-FU] y oxaliplatino) con control activo de los síntomas o solo control activo de los síntomas. Al cabo de una mediana de seguimiento de 21,7 meses, se observó lo siguiente:[Nivel de evidencia A1]
- La mediana de SG fue significativamente más prolongada en el grupo FOLFOX (6,2 meses) que en el grupo que solo recibió control activo de los síntomas (5,3 meses) (CRI ajustado, 0,69; IC 95 %, 0,50−0,97; P = 0,031). En el grupo FOLFOX, la tasa de SG fue del 50,6 % a los 6 meses y del 25,9 % a los 12 meses, en comparación con la del grupo que solo recibió control activo de los síntomas, que fue del 35,5 % a los 6 meses y del 11,4 % a los 12 meses.
- Se notificaron efectos adversos de grado 3 a 5 en 56 (69 %) pacientes del grupo FOLFOX y en 42 (52 %) pacientes del grupo de control activo de los síntomas. Los efectos adversos de grado 3 a 5 relacionados con FOLFOX notificados de manera más frecuente fueron neutropenia (12 %), cansancio o letargo (11 %) e infección (10 %). Hubo 3 muertes relacionadas con la quimioterapia, una por infección, una por lesión renal aguda y otra por neutropenia febril.
- En un ensayo multicéntrico de fase IIb en Corea del Sur (NIFTY [NCT03524508]), se asignaron al azar 174 pacientes con cáncer biliar metastásico que progresó durante el tratamiento con cisplatino y gemcitabina de primera línea, para recibir 5-FU y leucovorina, con irinotecán liposomal o sin este. Al cabo de una mediana de seguimiento de 6,1 meses se observaron los siguientes resultados:[Nivel de evidencia A1]
- El criterio principal de valoración de la mediana de SSC fue significativamente más prolongado en el grupo que recibió irinotecán liposomal (3,9 meses) en comparación con el grupo que recibió 5-FU y leucovorina sola (1,6 meses) (CRI, 0,38; IC 95 %, sin notificar; P = 0,0001). Uno de los criterios secundarios de valoración de la mediana de SG también fue significativamente más prolongado en el grupo que recibió irinotecán liposomal (8,6 meses) en comparación con el grupo que recibió 5-FU y leucovorina sola (5,3 meses) (CRI, 0,68; IC 95 %, sin notificar; P = 0,024).
Inmunoterapia
A partir de los resultados de los ensayos TOPAZ-1 y KEYNOTE-966,, todos los pacientes con enfermedad irresecable, metastásica o recidivante deben considerar el tratamiento con un inhibidor de puntos de control (durvalumab o pembrolizumab) en combinación con cisplatino y gemcitabina (doblete de tratamiento estándar anterior) en el entorno del tratamiento de primera línea.
Evidencia (inmunoterapia):
- En un estudio multicéntrico internacional de fase III (TOPAZ-1 [NCT03875235]) se incluyó a 685 pacientes con cáncer biliar metastásico, recidivante, o localmente avanzado irresecable que no habían recibido tratamiento. Los pacientes se asignaron al azar para recibir durvalumab o placebo con cisplatino y gemcitabina hasta por 8 ciclos, seguidos de mantenimiento con durvalumab o placebo hasta que se presentara progresión de la enfermedad o toxicidad inaceptable. Después de una mediana de seguimiento de 13,7 meses para los pacientes en el grupo de durvalumab, se observaron los siguientes resultados:[Nivel de evidencia A1]
- El criterio principal de valoración de la mediana de SG mejoró de forma significativa en el grupo de durvalumab (12,8 meses) en comparación con el grupo de placebo (11,5 meses) (CRI, 0,80; IC 95 %, 0,66–0,97; P = 0,021). En el grupo de durvalumab, la tasa de SG fue del 35,1 % a los 18 meses y del 24,9 % a los 24 meses, en comparación con el 25,5 % a los 18 meses y del 10,4 % a los 24 meses en el grupo de placebo.
- No hubo diferencia significativa entre los grupos en el número de efectos adversos de grado 3 o 4 relacionados con el tratamiento ni en el número de episodios que causaran la interrupción del medicamento en estudio.
- En un estudio multicéntrico internacional de fase III (KEYNOTE-966 [NCT04003636]) se incluyeron 1069 pacientes con cáncer de vías biliares metastásico, localmente avanzado o irresecable que no habían recibido tratamiento. Los pacientes se asignaron al azar para recibir pembrolizumab o placebo por un máximo de 35 ciclos. Esto se combinó con gemcitabina (sin una duración máxima) y cisplatino por hasta 8 ciclos. Al cabo de una mediana de seguimiento de 25,6 meses, se observaron los siguientes resultados:[Nivel de evidencia A1]
- La mediana de SG fue de 12,7 meses en el grupo de pembrolizumab y 10,9 meses en el grupo de placebo (CRI, 0,83; IC 95 %, 0,72–0,95; P unilateral = 0,0034).
- No hubo diferencia entre los grupos en la frecuencia total de efectos adversos relacionados con el tratamiento, incluso en los efectos de grado 3 o grado 4. Hubo 8 muertes por efectos adversos relacionados con el tratamiento (2 %) en el grupo de pembrolizumab y 3 (1%) en el grupo de placebo.
Todos los pacientes con enfermedad recidivante, metastásica o irresecable que no han recibido un inhibidor de puntos de control se deben someter a pruebas moleculares para determinar la presencia de tumores con deficiencia en la reparación de errores de emparejamiento (dMMR) o inestabilidad microsatelital alta (MSI-H). Según la extrapolación de los datos de un subgrupo de pacientes con tumores gastrointestinales y hepatopancreaticobiliares de los estudios I-PREDICT (NCT02534675) y KEYNOTE-158 (NCT02628067), los pacientes con tumores que exhiben dMMR o MSI-H pueden considerar el tratamiento con pembrolizumab.[Nivel de evidencia C3]
Terapia dirigida
Se debe considerar la participación en ensayos clínicos de terapias en investigación para los pacientes con mutaciones susceptibles de tratamiento. En la actualidad, las terapias dirigidas se han aprobado solo para pacientes cuya enfermedad progresó o que no son aptos para el tratamiento de primera línea.
Inhibidores de IDH1
Hasta el 15 % de los cánceres de vías biliares expresan una mutación en el gen IDH1
Evidencia (inhibidores de IDH1):
- En el ensayo de fase III, ClarIDHy (NCT02989857), participaron 187 pacientes de colangiocarcinoma con mutación en IDH1 que progresó durante un tratamiento sistémico anterior. Los pacientes se asignaron al azar para recibir el inhibidor de IDH1 ivosidenib o un placebo. Se observaron los siguientes resultados:[Nivel de evidencia B1]
- La mediana de SSP (criterio principal de valoración) mejoró entre los pacientes tratados con ivosidenib (2,7 meses) en comparación con placebo (1,4 meses), (CRI, 0,37; IC 95 %, 0,25−0,54; P< 0,001). Las tasas de SSP a los 6 y 12 meses fueron del 32 % y del 21,9 %, respectivamente, en el grupo de ivosidenib. Todos los pacientes en el grupo de placebo presentaron progresión a los 6 meses.
- En el análisis por intención de tratar, la mediana de SG fue de 10,3 meses en el grupo de ivosidenib en comparación con 7,5 meses en el grupo de placebo (CRI, 0,79; P unilateral = 0,09), a pesar de un cruce del 57 % de los pacientes del grupo de placebo al grupo de ivosidenib. Cuando se hizo el ajuste según el cruce, la mediana de SG para el grupo de placebo fue de 5,1 meses.
- Se presentaron efectos tóxicos de grados 3 y 4 en el 46 % de los pacientes en el grupo de ivosidenib en comparación con el 36 % en los pacientes del grupo de placebo.
Inhibidores del receptor 2 del factor de crecimiento de fibroblastos (FGFR)
Cerca del 15 % de los colangiocarcinomas intrahepáticos exhiben fusiones de FGFR2. En múltiples ensayos de fase II, algunos notificados como resumen, se indicó actividad de los inhibidores de FGFR en los pacientes con colangiocarcinoma y fusiones de FGFR2 que progresaron después o que no eran aptos para la quimioterapia de primera línea.
Evidencia (inhibidores de FGFR):
- En el ensayo multicéntrico sin enmascaramiento de un solo grupo y de fase II, FIGHT-202 (NCT02924376) se inscribieron 147 pacientes que presentaron progresión de la enfermedad durante al menos un tratamiento previo o después de este. Un total de 108 pacientes albergaban reordenamientos o fusiones de FGFR2. Todos los pacientes recibieron 13,5 mg de pemigatinib oral una vez al día durante 14 días consecutivos, seguido por 7 días sin tratamiento. Al cabo de una mediana de seguimiento de 30,4 meses, se observaron los siguientes resultados:[Nivel de evidencia C3]
- La tasa de respuesta general en la cohorte de pacientes con reordenamientos o fusiones de FGFR2 fue del 37 % (IC 95 %, 27,9−46,9 %), incluso 4 respuestas completas. De los 40 pacientes que alcanzaron una respuesta objetiva, la mediana de duración de la respuesta fue de 8,1 meses.
- La mediana de SSP en los pacientes con reordenamientos o fusiones de FGFR2 fue de 7 meses (IC 95 %, 6,1–10,5) y la mediana de SG fue de 17,5 meses (IC 95 %, 14,4–22,9). Debido a que el diseño del estudio es de un solo grupo, todavía no se ha establecido el efecto relativo del pemigatinib en la SSP y la SG. Sin embargo, en la cohorte de pacientes del estudio cuyos tumores no albergaban reordenamientos de FGFR, la mediana de SSP fue de solo 1,5 meses y la mediana de SG fue de solo 4,0 meses.
- El efecto adverso más común fue la hiperfosfatemia, que se presentó en el 58,5 % de los pacientes, sin embargo ningún efecto adverso fue de grado 3 o superior. Los efectos adversos condujeron a la suspensión del tratamiento en un 10,2 % de los pacientes, la reducción de la dosis en un 13,64 % y la interrupción de la dosis en un 42,2 % de los pacientes.
En abril de 2020, la FDA otorgó la aprobación acelerada para el tratamiento con pemigatinib en adultos de colangiocarcinoma irresecable o metastásico con tratamiento previo y fusión o reordenamiento de FGFR2.
- El futibatinib es un inhibidor irreversible no competitivo de FGFR1–4. En los estudios in vitro preclínicos, se observó que el futibatinib fue menos sensible en mutaciones con resistencia específica cuando se comparó con el pemigatinib. Sin embargo, no hay datos de ensayos clínicos comparativos directos en los que se evalúen los desenlaces de varios inhibidores FGFR. En el ensayo multidimensional sin enmascaramiento de un solo grupo y de fase II, FOENIX-CCA2 (NCT02052778), se evaluó el futibatinib en pacientes con colangiocarcinoma intrahepático tratado antes y fusión o reordenamiento de FGFR2. En el estudio se inscribieron 103 pacientes con progresión de la enfermedad después de al menos 1 línea previa de tratamiento sistémico. Todos los pacientes recibieron futibatinib en dosis continua de 20 mg una vez al día.[Nivel de evidencia C3]
- La tasa de respuesta general fue del 42 % (IC 95 %, 31,1–50,4 %), incluso 1 respuesta completa. Entre los pacientes que tuvieron respuestas, la mediana de duración de la respuesta fue de 9,7 meses.
- La mediana de SSP fue de 9 meses (IC 95 %, 6,9–13,1) y la mediana de SG fue de 21,7 meses (IC 95 % 14,5–NA). Debido al diseño del estudio de un solo grupo, no se ha establecido el efecto relativo del futibatinib en la SSP y la SG.
- El efecto adverso más común de cualquier grado fue la hiperfosfatemia, que se presentó en el 85 % de los pacientes y fue de grado 3 en el 30 % de ellos. Otros efectos adversos comunes fueron alopecia (33 %), xerostomía (30 %), piel seca (27 %) y fatiga (25 %). Otros efectos adversos de grado 3 notables son elevación de la aspartato– aminotransferasa (7 %) y estomatitis (6 %). Los eventos adversos relacionados con el tratamiento produjeron interrupciones de la dosis en el 50 % de los pacientes, reducciones de la dosis en el 54 % de los pacientes e interrupción permanente del fármaco en el 2 % de los pacientes.
Se debe alentar la participación en un ensayo clínico de los pacientes con enfermedad positiva para una fusión de FGFR2.
Terapia dirigida a HER2
- En el ensayo multicéntrico, internacional, de un solo grupo y de fase IIb HERIZON-BTC-01 (NCT04466891) se incluyeron 87 pacientes con cáncer de vías biliares irresecable, localmente avanzado o metastásico con amplificación de HER2 (mediante hibridación fluorescente in situ), cuya enfermedad progresó con un tratamiento anterior a base de gemcitabina. En la cohorte 1 se incluyeron 80 pacientes con expresión de HER2 de grado 2+ o 3+ mediante pruebas inmunohistoquímicas (IHC), mientras que en la cohorte 2 se incluyeron 7 pacientes con expresión de HER2 de grado 0+ o 1+ mediante IHC. Todos los pacientes recibieron zanidatamab, un anticuerpo biespecífico dirigido a 2 epítopos característicos de HER2, con una dosis intravenosa de 20 mg/kg cada 2 semanas. Al cabo de una mediana de seguimiento de 12,4 meses, se observaron los siguientes resultados:[Nivel de evidencia C3]
- En la cohorte 1, la tasa de respuesta objetiva fue del 41,3 % (IC 95 %, 30,4–52,8 %). La mediana de duración de la respuesta fue de 12,9 meses (IC 95 %, 6,0–no se alcanzó).
- La median de SSP fue de 5,5 meses en la cohorte 1 (IC 95 %, 3,7–7,2) y de 1,9 meses (IC 95 %, 1,2–no se pudo estimar) en la cohorte 2.
- Se presentaron efectos adversos serios relacionados con el tratamiento en el 8 % de los pacientes. Se tuvo que interrumpir la administración de zanidatamab en 2 pacientes: uno por fracción de eyección reducida y otro por neumonitis. Con relativa frecuencia se presentó diarrea (37 %) y reacciones a la infusión del primer ciclo (33 %), pero en su mayoría de grado bajo.
- La FDA ha otorgado al zanidatamab la denominación de tratamiento innovador en este entorno, pero todavía no ha aprobado su uso.
Hay un conjunto creciente de evidencia que demuestra la actividad del conjugado anticuerpo-fármaco trastuzumab deruxtecán en pacientes con tumores sólidos que expresan HER2, aunque todavía no ha sido aprobado por la FDA para el cáncer de vías biliares.
- El DESTINY-PanTumor02 (NCT04482309), que se notificó en forma de resumen, fue un ensayo de tratamiento indiscriminado para tumores malignos (participaron pacientes con tumores positivos para HER2 con independencia de su ubicación anatómica) en el que se incluyó un subgrupo de 41 pacientes con cáncer de vías biliares.[Nivel de evidencia C3]
- La tasa de respuesta general fue del 22 % en este subgrupo de pacientes.
- En el ensayo HERB (NCT04482309) de fase II, que se notificó en forma de resumen, se incluyeron 32 pacientes (24 presentaban enfermedad positiva para HER2 y 8 presentaban enfermedad con HER2 de grado bajo) con cánceres de vías biliares resistentes o intolerantes al régimen que contenía gemcitabina, y todos ellos se trataron con trastuzumab deruxtecán.[Nivel de evidencia C3]
- Entre los pacientes positivos para HER2, la tasa de respuesta general fue del 36,4 %. La mediana de SSP fue de 4,4 meses y la mediana de SG fue de 7,1 meses.
Asimismo, la combinación de tucatinib y trastuzumab (que aún no cuenta con la aprobación de la FDA para el tratamiento del cáncer de vías biliares, pero sí para el cáncer de mama y el cáncer colorrectal) demostró una posible actividad en pacientes que ya habían recibido tratamiento.
- En el estudio de fase II SGNTUC-019 (NCT04579380) sobre todo tipo de neoplasias malignas se evaluó la combinación de tucatinib y trastuzumab. Se incluyó una cohorte de 30 pacientes con cáncer de vías biliares con amplificación o sobrexpresión de HER2, que ya habían recibido tratamiento.[Nivel de evidencia C3]
- Al cabo de una mediana de seguimiento de 10,8 meses, la tasa de respuesta objetiva fue del 46,7 % (IC 90 %, 30,8 –63,0 %) y la tasa de control de la enfermedad fue del 76,7 % (IC 90 %, 60,6 –88,5 %).
- La mediana de SSP fue de 5,5 meses (IC 90 %, 3,9–8,2).
- Los eventos adversos relacionados con el tratamiento que se presentaron con más frecuencia fueron fiebre (43,3 %) y diarrea (40 %). Los eventos adversos no provocaron ninguna muerte, pero fueron la causa de que 1 paciente discontinuara el tratamiento.
Los pacientes que presentaban enfermedad con amplificación de HER2 fueron aptos para participar en ensayos clínicos.
Se alienta la participación de todos los pacientes en ensayos clínicos de terapias adyuvantes. Para obtener más información sobre ensayos clínicos en curso, consultar el portal de Internet del NCI.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
References
- Nordback IH, Pitt HA, Coleman J, et al.: Unresectable hilar cholangiocarcinoma: percutaneous versus operative palliation. Surgery 115 (5): 597-603, 1994.
- Levy MJ, Baron TH, Gostout CJ, et al.: Palliation of malignant extrahepatic biliary obstruction with plastic versus expandable metal stents: An evidence-based approach. Clin Gastroenterol Hepatol 2 (4): 273-85, 2004.
- Barney BM, Olivier KR, Miller RC, et al.: Clinical outcomes and toxicity using stereotactic body radiotherapy (SBRT) for advanced cholangiocarcinoma. Radiat Oncol 7: 67, 2012.
- Hyder O, Marsh JW, Salem R, et al.: Intra-arterial therapy for advanced intrahepatic cholangiocarcinoma: a multi-institutional analysis. Ann Surg Oncol 20 (12): 3779-86, 2013.
- Valle J, Wasan H, Palmer DH, et al.: Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med 362 (14): 1273-81, 2010.
- Kim ST, Kang JH, Lee J, et al.: Capecitabine plus oxaliplatin versus gemcitabine plus oxaliplatin as first-line therapy for advanced biliary tract cancers: a multicenter, open-label, randomized, phase III, noninferiority trial. Ann Oncol 30 (5): 788-795, 2019.
- Lamarca A, Palmer DH, Wasan HS, et al.: Second-line FOLFOX chemotherapy versus active symptom control for advanced biliary tract cancer (ABC-06): a phase 3, open-label, randomised, controlled trial. Lancet Oncol 22 (5): 690-701, 2021.
- Yoo C, Kim KP, Kim I, et al.: Final results from the NIFTY trial, a phase IIb, randomized, open-label study of liposomal Irinotecan (nal-IRI) plus fluorouracil (5-FU)/leucovorin (LV) in patients (pts) with previously treated metastatic biliary tract cancer (BTC). Ann Oncol 33 (Suppl 7): S565, 2022.
- Kelley RK, Ueno M, Yoo C, et al.: Pembrolizumab in combination with gemcitabine and cisplatin compared with gemcitabine and cisplatin alone for patients with advanced biliary tract cancer (KEYNOTE-966): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 401 (10391): 1853-1865, 2023.
- Oh DY, He AR, Qin S, et al.: Updated overall survival (OS) from the phase III TOPAZ-1 study of durvalumab (D) or placebo (PBO) plus gemcitabine and cisplatin (+ GC) in patients (pts) with advanced biliary tract cancer (BTC). Ann Oncol 33 (Suppl 7): S565-S566, 2022.
- Sicklick JK, Kato S, Okamura R, et al.: Molecular profiling of cancer patients enables personalized combination therapy: the I-PREDICT study. Nat Med 25 (5): 744-750, 2019.
- Marabelle A, Le DT, Ascierto PA, et al.: Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase II KEYNOTE-158 Study. J Clin Oncol 38 (1): 1-10, 2020.
- Abou-Alfa GK, Macarulla T, Javle MM, et al.: Ivosidenib in IDH1-mutant, chemotherapy-refractory cholangiocarcinoma (ClarIDHy): a multicentre, randomised, double-blind, placebo-controlled, phase 3 study. Lancet Oncol 21 (6): 796-807, 2020.
- Zhu AX, Macarulla T, Javle MM, et al.: Final Overall Survival Efficacy Results of Ivosidenib for Patients With Advanced Cholangiocarcinoma With IDH1 Mutation: The Phase 3 Randomized Clinical ClarIDHy Trial. JAMA Oncol 7 (11): 1669-1677, 2021.
- Mazzaferro V, El-Rayes BF, Droz Dit Busset M, et al.: Derazantinib (ARQ 087) in advanced or inoperable FGFR2 gene fusion-positive intrahepatic cholangiocarcinoma. Br J Cancer 120 (2): 165-171, 2019.
- Abou-Alfa GK, Sahai V, Hollebecque A, et al.: Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 study. Lancet Oncol 21 (5): 671-684, 2020.
- Droz Dit Busset M, Braun S, El-Rayes B, et al.: Efficacy of derazantinib (DZB) in patients (pts) with intrahepatic cholangiocarcinoma (ICCA) expressing FGFR2-fusion or FGFR2 mutations/amplifications. [Abstract] Ann Oncol 30 (Suppl 5): A-721P, 2019.
- Goyal L, Meric-Bernstam F, Hollebecque A, et al.: Futibatinib for FGFR2-Rearranged Intrahepatic Cholangiocarcinoma. N Engl J Med 388 (3): 228-239, 2023.
- Harding JJ, Fan J, Oh DY, et al.: Zanidatamab for HER2-amplified, unresectable, locally advanced or metastatic biliary tract cancer (HERIZON-BTC-01): a multicentre, single-arm, phase 2b study. Lancet Oncol 24 (7): 772-782, 2023.
- Meric-Bernstam F, Makker V, Oaknin A, et al.: Efficacy and safety of trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2-expressing solid tumors: DESTINY-PanTumor02 (DP-02) interim results. [Abstract] J Clin Oncol 41 (Suppl 17): A-LBA3000, 2023.
- Ohba A, Morizane C, Kawamoto Y, et al.: Trastuzumab deruxtecan (T-DXd; DS-8201) in patients (pts) with HER2-expressing unresectable or recurrent biliary tract cancer (BTC): An investigator-initiated multicenter phase 2 study (HERB trial). [Abstract] J Clin Oncol 40 (Suppl 16): A-4006, 2022.
- Nakamura Y, Mizuno N, Sunakawa Y, et al.: Tucatinib and Trastuzumab for Previously Treated Human Epidermal Growth Factor Receptor 2-Positive Metastatic Biliary Tract Cancer (SGNTUC-019): A Phase II Basket Study. J Clin Oncol 41 (36): 5569-5578, 2023.
Actualizaciones más recientes a este resumen (04/05/2024)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Tratamiento del cáncer de vías biliares irresecable (incluye el cáncer metastásico y recidivante)
Se añadió texto para indicar que la combinación de tucatinib y trastuzumab (que aún no cuenta con la aprobación de la Administración de Alimentos y Medicamentos de los Estados Unidos para el tratamiento del cáncer de vías biliares, pero sí para el cáncer de mama y el cáncer colorrectal) demostró una posible actividad en pacientes que ya habían recibido tratamiento.
Se añadió texto sobre los resultados de un estudio de fase II para todo tipo de neoplasias malignas en el que se evaluó la combinación de tucatinib y trastuzumab en una cohorte de 30 pacientes con cáncer de vías biliares con amplificación o sobrexpresión de HER2, que ya habían recibido tratamiento (se citó a Nakamura et al. como referencia 22 y un nivel de evidencia C3).
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de vías biliares. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El Consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de vías biliares (colangiocarcinoma) son:
- Amit Chowdhry, MD, PhD (University of Rochester Medical Center)
- Valerie Lee, MD (Johns Hopkins University)
- Leon Pappas, MD, PhD (Dana-Farber Cancer Institute)
- Ari Seifter, MD (University of Illinois at Chicago)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El Consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de vías biliares (colangiocarcinoma). Bethesda, MD: National Cancer Institute. Actualización:
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.