Instituto Nacional del Cáncer
Fecha de publicación: Jan 16, 2024
Resumen de información revisada por expertos acerca del tratamiento del cáncer de colon.
Tratamiento del cáncer de colon
Información general sobre el cáncer de colon
El cáncer de colon es una enfermedad muy tratable y a menudo curable cuando se localiza en el intestino. El tratamiento primario es la cirugía y produce cura en cerca del 50 % de los pacientes. La recidiva después de la cirugía es un problema grave y con frecuencia es la causa definitiva de muerte.
Incidencia y mortalidad
Número estimado de casos nuevos y defunciones por cáncer de colon y cáncer de recto en los Estados Unidos para 2022:
- Casos nuevos de cáncer de colon: 106 180.
- Casos nuevos de cáncer de recto: 44 850.
- Defunciones: 52 580 (cáncer de colon y cáncer de recto combinados).
En el colon también surgen tumores de estroma gastrointestinal. (Para obtener más información, consultar el sumario del PDQ Tratamiento de los tumores de estroma gastrointestinal).
Características anatómicas
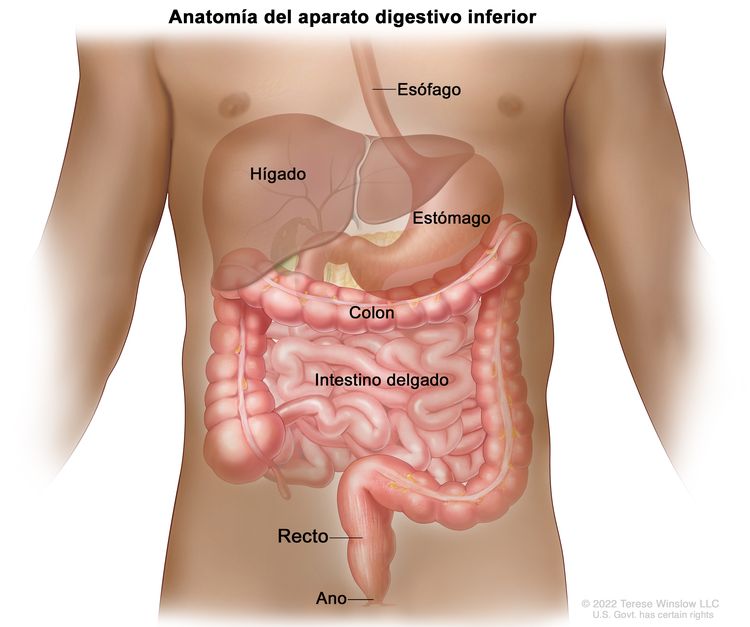 Anatomía del aparato digestivo (gastrointestinal) inferior.
Anatomía del aparato digestivo (gastrointestinal) inferior.
Factores de riesgo
colorectal cancerEl envejecimiento es el factor de riesgo más importante para la mayoría de cánceres. Otros factores de riesgo del cáncer colorrectal son los siguientes:
- Antecedentes familiares de cáncer colorrectal en un pariente de primer grado.
- Antecedentes personales de adenomas colorrectales, cáncer colorrectal o cáncer de ovario.
- Afecciones hereditarias, como la poliposis adenomatosa familiar (PAF) y el síndrome de Lynch (cáncer de colon sin poliposis hereditario [HNPCC]).
- Antecedentes personales de colitis ulcerosa crónica o colitis de Crohn duraderas.
- Consumo excesivo de alcohol.
- Consumo de tabaco.
- Raza u origen étnico: afroamericano.
- Obesidad.
Exámenes de detección
Debido a la frecuencia de la enfermedad, la capacidad para identificar grupos de riesgo alto, el crecimiento lento de las lesiones primarias, la supervivencia más alta de los pacientes con lesiones en estadios tempranos, y la relativa simplicidad y exactitud de los exámenes de detección; la detección del cáncer de colon debe formar parte de la atención habitual de todos los adultos de 50 o más años, en especial si tienen parientes de primer grado con cáncer colorrectal. (Para obtener más información, consultar el sumario del PDQ Exámenes de detección del cáncer colorrectal).
Factores pronósticos
El pronóstico para los pacientes de cáncer de colon se relaciona de manera evidente con las siguientes características:
- El grado de penetración del tumor a través de la pared intestinal.
- La presencia o ausencia de compromiso ganglionar.
- La presencia o ausencia de metástasis a distancia.
Todos los sistemas de estadificación de esta enfermedad se fundamentan en estas tres características.
Otros factores pronósticos son los siguientes:
- La obstrucción intestinal y la perforación intestinal son indicadores de un pronóstico precario.
- Las concentraciones séricas elevadas del antígeno carcinoembrionario (ACE) antes del tratamiento indican un pronóstico adverso.
En los pacientes de cáncer de colon, se han evaluado de manera retrospectiva muchos otros marcadores pronósticos, aunque la mayoría, como la pérdida alélica del cromosoma 18q y la expresión de la timidilato sintasa no se han validado de manera prospectiva. En una serie poblacional con 607 pacientes menores de 50 años que tenían cáncer colorrectal, se relacionó la inestabilidad microsatelital, que también se vinculó con el HNPCC, con una mejora de la supervivencia sin importar el estadio tumoral. En el análisis estratificado por estadio, se notificó que los pacientes con HNPCC tenían mejor pronóstico que los pacientes con cáncer colorrectal esporádico; pero la naturaleza retrospectiva de los estudios y la posibilidad de factores de selección dificultan la interpretación de esta observación.
Las decisiones sobre el tratamiento dependen de factores como las preferencias de médicos y pacientes, así como el estadio de la enfermedad, en lugar de la edad del paciente.
Se observaron diferencias raciales en la supervivencia general (SG) después de la terapia adyuvante, pero no se observaron diferencias en la supervivencia sin enfermedad; lo que indica que las afecciones comórbidas inciden en los resultados de supervivencia en diferentes poblaciones de pacientes.
Seguimiento y supervivencia
Se dispone de datos limitados y no se dispone de evidencia científica de nivel alto para orientar a los pacientes y médicos acerca de la vigilancia y el tratamiento de los pacientes después de la resección quirúrgica y la terapia adyuvante. La American Society of Clinical Oncology y la National Comprehensive Cancer Network recomiendan estrategias específicas de seguimiento y vigilancia.
Después del tratamiento del cáncer de colon, las evaluaciones periódicas quizás permitan identificar y tratar de manera temprana una enfermedad recidivante. Sin embargo, el efecto de la vigilancia en la mortalidad general de los pacientes con cáncer de colon recidivante está limitado por la proporción relativamente baja de pacientes que tienen metástasis localizadas con posibilidad de curación. Hasta la fecha, en ningún ensayo aleatorizado de gran escala se documentó algún beneficio para la SG de los programas de vigilancia posoperatoria estándar.
El ACE es una glucoproteína sérica que se utiliza con frecuencia durante la atención de pacientes con cáncer de colon. Una revisión sobre el uso de este marcador tumoral indica lo siguiente:
- La concentración del ACE no constituye un examen de detección útil para el cáncer colorrectal por el gran número de resultados positivos falsos y negativos falsos.
- La prueba de ACE posoperatoria se debe restringir a los pacientes que serían aptos para someterse a resección de metástasis hepáticas o pulmonares.
- No se debe recomendar el uso habitual solo de las concentraciones del ACE para vigilar la respuesta al tratamiento.
No se ha determinado bien el régimen óptimo ni la frecuencia de los exámenes de seguimiento porque no está claro el efecto en la supervivencia y la calidad de la información es deficiente.
Factores relacionados con recidiva
Alimentación y ejercicio
No hay ensayos prospectivos aleatorizados en los que se demuestre una mejora en el desenlace gracias a un régimen de alimentación o ejercicio; sin embargo, en estudios de cohortes se indica que un régimen de alimentación o ejercicio quizás mejore el desenlace clínico. Los estudios de cohortes contienen múltiples oportunidades de sesgo no intencional y se debe ejercer cautela al utilizar estos datos.
Se llevaron a cabo dos estudios prospectivos observacionales de pacientes inscritos en el ensayo Cancer and Leukemia Group B (CALGB-89803 [NCT00003835]), que fue un ensayo de quimioterapia adyuvante para pacientes con cáncer de colon en estadio III. En este ensayo, los pacientes en el quintil más bajo del modelo alimentario occidental, en comparación con los pacientes en el quintil más alto, presentaron un cociente de riesgos instantáneos (CRI) ajustado para la supervivencia sin enfermedad de 3,25 (intervalo de confianza [IC] 95 %, 2,04–5,19; P< 0,001) y una SG de 2,32 (IC 95 %, 1,36–3,96; P< 0,001). Además, también se identificó que los pacientes con cáncer de colon en estadio III en el quintil más alto de carga glucémica en la alimentación presentaron un CRI ajustado para la SG de 1,76 (IC 95 %, 1,22–2,54; P< 0,001) en comparación con los pacientes del quintil más bajo. Después, en el Cancer Prevention Study II Nutrition Cohort que incluyó a 2315 participantes con diagnóstico de cáncer colorrectal, se encontró que, si bien el grado de consumo de carne roja y procesada antes del diagnóstico se relacionó con un mayor riesgo de muerte (riesgo relativo [RR], 1,29; IC 95 %, 1,05–1,59; P = 0,03), el consumo de carne roja después del diagnóstico no se relacionó con la mortalidad general.[Nivel de evidencia C1]
En un metanálisis de siete estudios prospectivos de cohortes en los que se evaluó la actividad física antes y después del diagnóstico de cáncer colorrectal, se observó que los pacientes que realizaron cualquier grado de actividad física antes del diagnóstico tenían un RR de 0,75 (IC 95 %, 0,65–0,87; P< 0,001) para la mortalidad específica del cáncer colorrectal en comparación con los pacientes que no se ejercitaban. Los pacientes con un grado alto de actividad física (vs. grado bajo) antes del diagnóstico tuvieron un RR de 0,70 (IC 95 %, 0,56-0,87; P = 0,002). Los pacientes que realizaron alguna actividad física (comparada con ninguna actividad) después del diagnóstico tuvieron un RR de 0,74 (IC 95 %, 0,58–0,95; P = 0,02) de mortalidad específica del cáncer colorrectal. Los pacientes que realizaron un grado alto de actividad física (vs. grado bajo) después del diagnóstico tuvieron un RR de 0,65 (IC 95 %, 0,47–0,92; P = 0,01).[Nivel de evidencia C1]
Aspirina
En un estudio prospectivo de cohortes, se examinó el uso de aspirina después del diagnóstico de cáncer colorrectal. Los pacientes que consumieron aspirina de manera habitual después del diagnóstico de cáncer colorrectal presentaron un CRI de supervivencia específica del cáncer de colon de 0,71 (IC 95 %, 0,65–0,97) y una SG de 0,79 (IC 95 %, 0,65–0,97).[Nivel de evidencia C1] En un estudio se evaluó a 964 pacientes con cáncer de recto y colon del Nurse’s Health Study y Health Professionals Follow-up Study. Entre los pacientes con cáncer colorrectal que expresaban una mutación en PI3K, el consumo habitual de aspirina se relacionó con un CRI de SG de 0,54 (IC 95 %, 0,31–0,94; P = 0,01).[Nivel de evidencia C1]
Sumarios relacionados
Otros sumarios del PDQ que contienen información sobre el cáncer de colon son los siguientes:
- Prevención del cáncer colorrectal
- Exámenes de detección del cáncer colorrectal
- Tratamiento del cáncer colorrectal infantil
El siguiente sumario solo está disponible en inglés:
- Genetics of Colorectal Cancer
References
- American Cancer Society: Cancer Facts and Figures 2022. American Cancer Society, 2022. Available online. Last accessed October 7, 2022.
- Johns LE, Houlston RS: A systematic review and meta-analysis of familial colorectal cancer risk. Am J Gastroenterol 96 (10): 2992-3003, 2001.
- Imperiale TF, Juluri R, Sherer EA, et al.: A risk index for advanced neoplasia on the second surveillance colonoscopy in patients with previous adenomatous polyps. Gastrointest Endosc 80 (3): 471-8, 2014.
- Singh H, Nugent Z, Demers A, et al.: Risk of colorectal cancer after diagnosis of endometrial cancer: a population-based study. J Clin Oncol 31 (16): 2010-5, 2013.
- Srinivasan R, Yang YX, Rubin SC, et al.: Risk of colorectal cancer in women with a prior diagnosis of gynecologic malignancy. J Clin Gastroenterol 41 (3): 291-6, 2007.
- Mork ME, You YN, Ying J, et al.: High Prevalence of Hereditary Cancer Syndromes in Adolescents and Young Adults With Colorectal Cancer. J Clin Oncol 33 (31): 3544-9, 2015.
- Laukoetter MG, Mennigen R, Hannig CM, et al.: Intestinal cancer risk in Crohn's disease: a meta-analysis. J Gastrointest Surg 15 (4): 576-83, 2011.
- Fedirko V, Tramacere I, Bagnardi V, et al.: Alcohol drinking and colorectal cancer risk: an overall and dose-response meta-analysis of published studies. Ann Oncol 22 (9): 1958-72, 2011.
- Liang PS, Chen TY, Giovannucci E: Cigarette smoking and colorectal cancer incidence and mortality: systematic review and meta-analysis. Int J Cancer 124 (10): 2406-15, 2009.
- Laiyemo AO, Doubeni C, Pinsky PF, et al.: Race and colorectal cancer disparities: health-care utilization vs different cancer susceptibilities. J Natl Cancer Inst 102 (8): 538-46, 2010.
- Lansdorp-Vogelaar I, Kuntz KM, Knudsen AB, et al.: Contribution of screening and survival differences to racial disparities in colorectal cancer rates. Cancer Epidemiol Biomarkers Prev 21 (5): 728-36, 2012.
- Ma Y, Yang Y, Wang F, et al.: Obesity and risk of colorectal cancer: a systematic review of prospective studies. PLoS One 8 (1): e53916, 2013.
- Steinberg SM, Barkin JS, Kaplan RS, et al.: Prognostic indicators of colon tumors. The Gastrointestinal Tumor Study Group experience. Cancer 57 (9): 1866-70, 1986.
- Filella X, Molina R, Grau JJ, et al.: Prognostic value of CA 19.9 levels in colorectal cancer. Ann Surg 216 (1): 55-9, 1992.
- McLeod HL, Murray GI: Tumour markers of prognosis in colorectal cancer. Br J Cancer 79 (2): 191-203, 1999.
- Jen J, Kim H, Piantadosi S, et al.: Allelic loss of chromosome 18q and prognosis in colorectal cancer. N Engl J Med 331 (4): 213-21, 1994.
- Lanza G, Matteuzzi M, Gafá R, et al.: Chromosome 18q allelic loss and prognosis in stage II and III colon cancer. Int J Cancer 79 (4): 390-5, 1998.
- Griffin MR, Bergstralh EJ, Coffey RJ, et al.: Predictors of survival after curative resection of carcinoma of the colon and rectum. Cancer 60 (9): 2318-24, 1987.
- Johnston PG, Fisher ER, Rockette HE, et al.: The role of thymidylate synthase expression in prognosis and outcome of adjuvant chemotherapy in patients with rectal cancer. J Clin Oncol 12 (12): 2640-7, 1994.
- Shibata D, Reale MA, Lavin P, et al.: The DCC protein and prognosis in colorectal cancer. N Engl J Med 335 (23): 1727-32, 1996.
- Bauer KD, Lincoln ST, Vera-Roman JM, et al.: Prognostic implications of proliferative activity and DNA aneuploidy in colonic adenocarcinomas. Lab Invest 57 (3): 329-35, 1987.
- Bauer KD, Bagwell CB, Giaretti W, et al.: Consensus review of the clinical utility of DNA flow cytometry in colorectal cancer. Cytometry 14 (5): 486-91, 1993.
- Sun XF, Carstensen JM, Zhang H, et al.: Prognostic significance of cytoplasmic p53 oncoprotein in colorectal adenocarcinoma. Lancet 340 (8832): 1369-73, 1992.
- Roth JA: p53 prognostication: paradigm or paradox? Clin Cancer Res 5 (11): 3345, 1999.
- Gryfe R, Kim H, Hsieh ET, et al.: Tumor microsatellite instability and clinical outcome in young patients with colorectal cancer. N Engl J Med 342 (2): 69-77, 2000.
- Watson P, Lin KM, Rodriguez-Bigas MA, et al.: Colorectal carcinoma survival among hereditary nonpolyposis colorectal carcinoma family members. Cancer 83 (2): 259-66, 1998.
- Iwashyna TJ, Lamont EB: Effectiveness of adjuvant fluorouracil in clinical practice: a population-based cohort study of elderly patients with stage III colon cancer. J Clin Oncol 20 (19): 3992-8, 2002.
- Chiara S, Nobile MT, Vincenti M, et al.: Advanced colorectal cancer in the elderly: results of consecutive trials with 5-fluorouracil-based chemotherapy. Cancer Chemother Pharmacol 42 (4): 336-40, 1998.
- Popescu RA, Norman A, Ross PJ, et al.: Adjuvant or palliative chemotherapy for colorectal cancer in patients 70 years or older. J Clin Oncol 17 (8): 2412-8, 1999.
- Dignam JJ, Colangelo L, Tian W, et al.: Outcomes among African-Americans and Caucasians in colon cancer adjuvant therapy trials: findings from the National Surgical Adjuvant Breast and Bowel Project. J Natl Cancer Inst 91 (22): 1933-40, 1999.
- Meyerhardt JA, Mangu PB, Flynn PJ, et al.: Follow-up care, surveillance protocol, and secondary prevention measures for survivors of colorectal cancer: American Society of Clinical Oncology clinical practice guideline endorsement. J Clin Oncol 31 (35): 4465-70, 2013.
- Benson AB, Bekaii-Saab T, Chan E, et al.: Localized colon cancer, version 3.2013: featured updates to the NCCN Guidelines. J Natl Compr Canc Netw 11 (5): 519-28, 2013.
- Martin EW, Minton JP, Carey LC: CEA-directed second-look surgery in the asymptomatic patient after primary resection of colorectal carcinoma. Ann Surg 202 (3): 310-7, 1985.
- Bruinvels DJ, Stiggelbout AM, Kievit J, et al.: Follow-up of patients with colorectal cancer. A meta-analysis. Ann Surg 219 (2): 174-82, 1994.
- Lautenbach E, Forde KA, Neugut AI: Benefits of colonoscopic surveillance after curative resection of colorectal cancer. Ann Surg 220 (2): 206-11, 1994.
- Khoury DA, Opelka FG, Beck DE, et al.: Colon surveillance after colorectal cancer surgery. Dis Colon Rectum 39 (3): 252-6, 1996.
- Safi F, Link KH, Beger HG: Is follow-up of colorectal cancer patients worthwhile? Dis Colon Rectum 36 (7): 636-43; discussion 643-4, 1993.
- Moertel CG, Fleming TR, Macdonald JS, et al.: An evaluation of the carcinoembryonic antigen (CEA) test for monitoring patients with resected colon cancer. JAMA 270 (8): 943-7, 1993.
- Rosen M, Chan L, Beart RW, et al.: Follow-up of colorectal cancer: a meta-analysis. Dis Colon Rectum 41 (9): 1116-26, 1998.
- Desch CE, Benson AB, Smith TJ, et al.: Recommended colorectal cancer surveillance guidelines by the American Society of Clinical Oncology. J Clin Oncol 17 (4): 1312, 1999.
- Benson AB, Desch CE, Flynn PJ, et al.: 2000 update of American Society of Clinical Oncology colorectal cancer surveillance guidelines. J Clin Oncol 18 (20): 3586-8, 2000.
- Clinical practice guidelines for the use of tumor markers in breast and colorectal cancer. Adopted on May 17, 1996 by the American Society of Clinical Oncology. J Clin Oncol 14 (10): 2843-77, 1996.
- Meyerhardt JA, Niedzwiecki D, Hollis D, et al.: Association of dietary patterns with cancer recurrence and survival in patients with stage III colon cancer. JAMA 298 (7): 754-64, 2007.
- Meyerhardt JA, Sato K, Niedzwiecki D, et al.: Dietary glycemic load and cancer recurrence and survival in patients with stage III colon cancer: findings from CALGB 89803. J Natl Cancer Inst 104 (22): 1702-11, 2012.
- McCullough ML, Gapstur SM, Shah R, et al.: Association between red and processed meat intake and mortality among colorectal cancer survivors. J Clin Oncol 31 (22): 2773-82, 2013.
- Je Y, Jeon JY, Giovannucci EL, et al.: Association between physical activity and mortality in colorectal cancer: a meta-analysis of prospective cohort studies. Int J Cancer 133 (8): 1905-13, 2013.
- Chan AT, Ogino S, Fuchs CS: Aspirin use and survival after diagnosis of colorectal cancer. JAMA 302 (6): 649-58, 2009.
- Liao X, Lochhead P, Nishihara R, et al.: Aspirin use, tumor PIK3CA mutation, and colorectal-cancer survival. N Engl J Med 367 (17): 1596-606, 2012.
Clasificación celular del cáncer de colon
Los tipos histológicos del cáncer de colon son los siguientes:
- Adenocarcinoma (la mayoría de los cánceres de colon).
- Adenocarcinoma mucinoso (coloide).
- Adenocarcinoma de células en anillo de sello.
- Tumores escirrosos.
- Neuroendocrinos. Los tumores con diferenciación neuroendocrina tienen de manera característica un pronóstico más precario que las variantes de adenocarcinoma puro.
References
- Saclarides TJ, Szeluga D, Staren ED: Neuroendocrine cancers of the colon and rectum. Results of a ten-year experience. Dis Colon Rectum 37 (7): 635-42, 1994.
Información sobre los estadios del cáncer de colon
Las decisiones de tratamiento se deben tomar a partir de la clasificación TNM (tumor, ganglio linfático y metástasis), en lugar de los modelos de clasificación antiguos Dukes o el Modified Astler-Coller.
Un grupo patrocinado por el American Joint Committee on Cancer (AJCC) y el Instituto Nacional del Cáncer recomendó que se examinen por lo menos 12 ganglios linfáticos en los pacientes con cáncer de colon y recto con el fin de corroborar que no hay compromiso tumoral ganglionar. Para esta recomendación se considera que el número de ganglios linfáticos que se examina refleja tanto la extensión de la disección mesentérica linfovascular en el momento de la resección quirúrgica, como la identificación patológica de los ganglios en la muestra. En estudios retrospectivos se demostró que es posible vincular el número de ganglios linfáticos examinados durante una cirugía de recto o colon con el desenlace del paciente.
Agrupamiento por estadios y definiciones TNM del American Joint Committee on Cancer
El AJCC designó la estadificación según la clasificación TNM para definir el cáncer de colon. La misma clasificación se usa para la estadificación clínica y patológica.
| Estadio | TNMb,c | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 251–74. | |||
| Las explicaciones de los superíndices b y c están al final del Cuadro 5. | |||
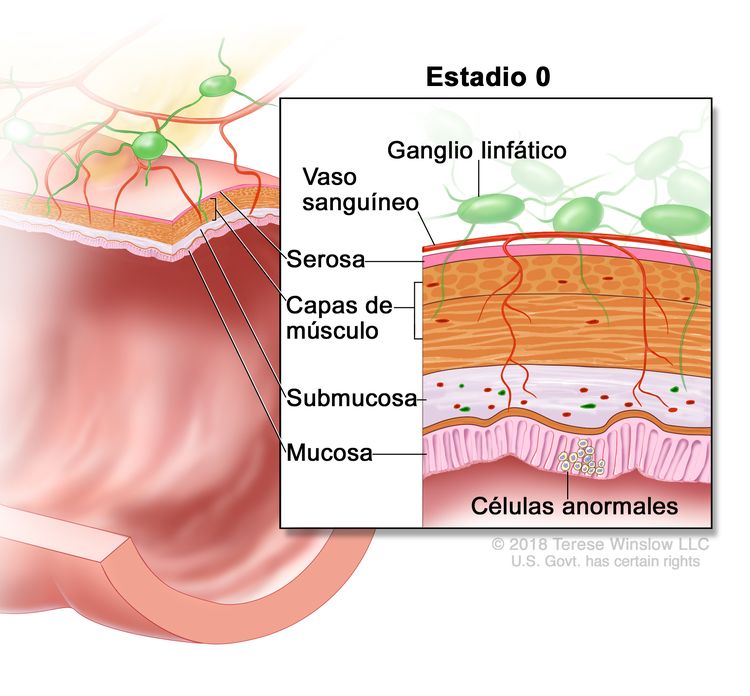
| 0 | Tis, N0, M0 | Tis = carcinoma in situ, carcinoma intramucoso (compromiso de la lámina propia sin diseminación a la capa muscular de la mucosa). |
|
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| Estadio | TNMb,c | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 251–74. | |||
| Las explicaciones de los superíndices b y c están al final del Cuadro 5. | |||
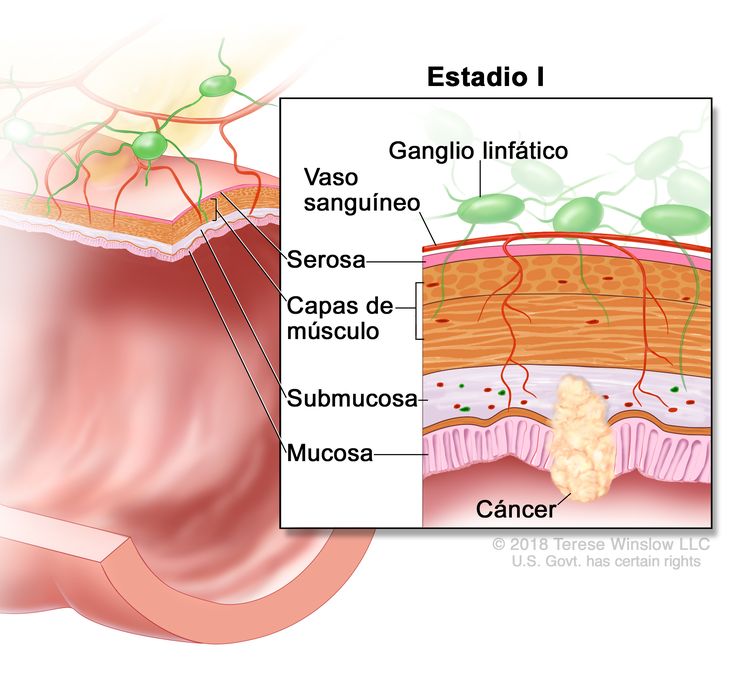
| I | T1, T2, N0, M0 | T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). |
|
| T2 = tumor con invasión de la capa muscular propia. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| Estadio | TNMb,c | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 251–74. | |||
| Las explicaciones de los superíndices b y c están al final del Cuadro 5. | |||
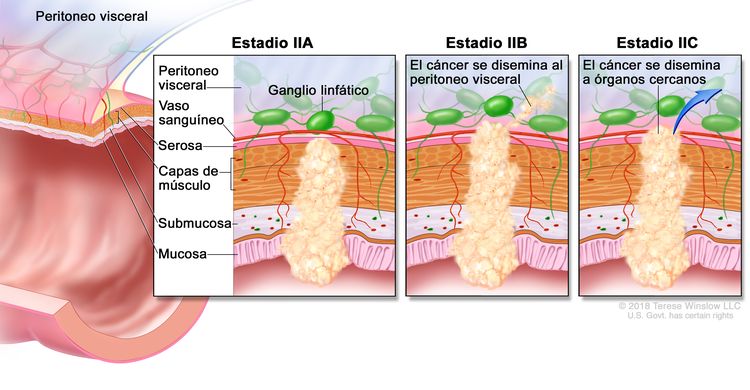
| IIA | T3, N0, M0 | T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. |
|
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| IIB | T4a, N0, M0 | T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión persistente de áreas inflamatorias en la superficie del peritoneo visceral). | |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| IIC | T4b, N0, M0 | T4b = tumor con invasión directa o adherencia a órganos o estructuras adyacentes. | |
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| Estadio | TNMb,c | Descripción | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 251–74. | |||
| Las explicaciones de los superíndices b y c están al final del Cuadro 5. | |||
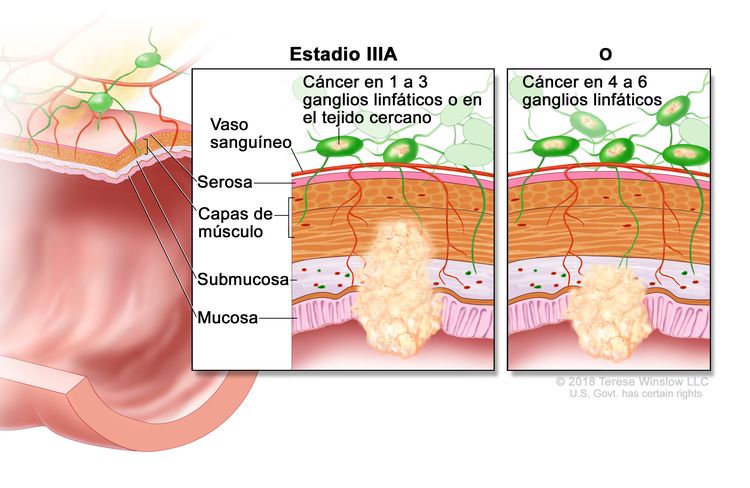
| IIIA | T1, N2a, M0 | T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). |
|
| N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T1–2, N1/N1c, M0 | T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). | ||
| T2 = tumor con invasión de la capa muscular propia. | |||
| N1 = compromiso de 1 a 3 ganglios linfáticos regionales (tumor en los ganglios linfáticos regionales que mide ≥0,2 mm), o cualquier cantidad de depósitos tumorales y todos los ganglios linfáticos identificables están libres de compromiso tumoral. | |||
| –N1c = sin compromiso de ganglios linfáticos regionales, pero con depósitos tumorales en la subserosa, el mesenterio, los tejidos pericólicos no peritonealizados o en los tejidos perirrectales o mesorrectales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
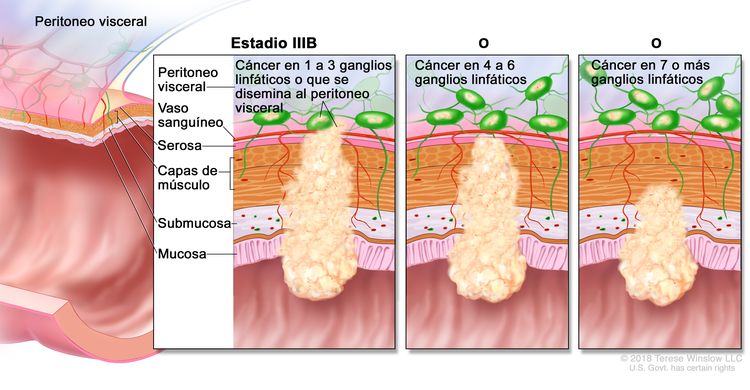
| IIIB | T1–T2, N2b, M0 | T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). |
|
| T2 = tumor con invasión de la capa muscular propia. | |||
| N2b = compromiso de 7 o más ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T2–T3, N2a, M0 | T2 = tumor con invasión de la capa muscular propia. | ||
| T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. | |||
| N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T3–T4a, N1/N1c, M0 | T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. | ||
| T4 = tumor con invasión del peritoneo visceral, o con invasión y adherencia a un órgano o estructura adyacente. | |||
| –T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión persistente de áreas inflamatorias en la superficie del peritoneo visceral). | |||
| N1 = compromiso de 1 a 3 ganglios linfáticos regionales (tumor en los ganglios linfáticos regionales que mide ≥0,2 mm), o cualquier cantidad de depósitos tumorales y todos los ganglios linfáticos identificables están libres de compromiso tumoral. | |||
| –N1c = sin compromiso de ganglios linfáticos regionales, pero con depósitos tumorales en la subserosa, el mesenterio, los tejidos pericólicos no peritonealizados o en los tejidos perirrectales o mesorrectales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
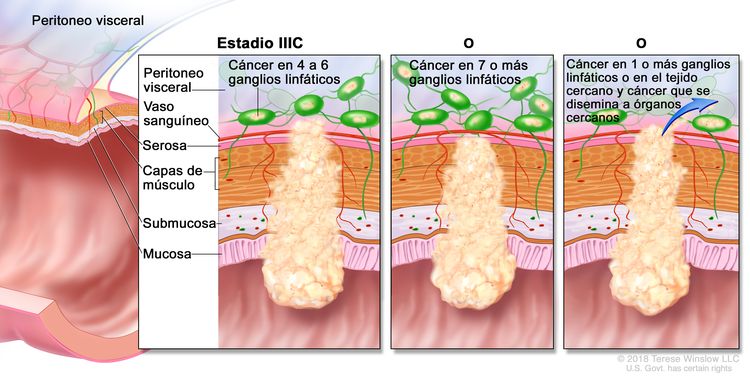
| IIIC | T3–T4a, N2b, M0 | T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. |
|
| T4 = tumor con invasión del peritoneo visceral, o con invasión y adherencia a un órgano o estructura adyacente. | |||
| –T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión persistente de áreas inflamatorias en la superficie del peritoneo visceral). | |||
| N2b = compromiso de 7 o más ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T4a, N2a, M0 | T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión persistente de áreas inflamatorias en la superficie del peritoneo visceral). | ||
| N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| T4b, N1–N2, M0 | T4b = tumor con invasión directa o adherencia a órganos o estructuras adyacentes. | ||
| N1 = compromiso de 1 a 3 ganglios linfáticos regionales (tumor en los ganglios linfáticos regionales que mide ≥0,2 mm), o cualquier cantidad de depósitos tumorales y todos los ganglios linfáticos identificables están libres de compromiso tumoral. | |||
| –N1a = compromiso de 1 ganglio linfático regional. | |||
| –N1b = compromiso de 2 o 3 ganglios linfáticos regionales. | |||
| –N1c = sin compromiso de ganglios linfáticos regionales, pero con depósitos tumorales en la subserosa, el mesenterio, los tejidos pericólicos no peritonealizados o en los tejidos perirrectales o mesorrectales. | |||
| N2 = compromiso de 4 o más ganglios linfáticos regionales. | |||
| –N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| –N2b = compromiso de 7 o más ganglios linfáticos regionales. | |||
| M0 = sin indicios de metástasis a distancia en las pruebas con imágenes, etc.; sin indicios de tumor en sitios u órganos distantes. (Esta categoría no la asigna un patólogo). | |||
| Estadio | TNMb,c | Definición | Imagen |
|---|---|---|---|
| T = tumor primario; N = ganglio linfático regional; M = metástasis a distancia. | |||
| aReproducción autorizada de AJCC: Colon and rectum. En: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. New York, NY: Springer, 2017, pp. 251–74. | |||
| bLa invasión directa en T4 incluye invasión de otros órganos o segmentos colorrectales por diseminación directa a través de la serosa. Esto se confirma mediante un examen microscópico (por ejemplo, un carcinoma de ciego que invade el colon sigmoide) o, en los cánceres retroperitoneales o subperitoneales, por la invasión directa de otros órganos o estructuras al diseminarse fuera de la capa muscular propia (es decir, un tumor en la pared posterior del colon descendente que invade el riñón izquierdo o la pared abdominal lateral; o cáncer de recto a nivel medio o distal con invasión de la próstata, las vesículas seminales, el cuello uterino o la vagina). | |||
| cUn tumor con adherencia macroscópica a otros órganos o estructuras se clasifica como cT4b. Sin embargo, si no hay tumor microscópico en la adherencia, la clasificación debe ser pT1–4a según la profundidad anatómica de la invasión en la pared. Las clasificaciones V y L se deben usar para identificar la presencia o ausencia de invasión vascular o linfática, mientras que el factor pronóstico PN se debe usar para la invasión perineural. | |||
| IVA | Cualquier T, cualquier N, M1a | TX = tumor primario no evaluable. |
|
| T0 = sin indicios de tumor primario. | |||
| Tis = carcinoma in situ, carcinoma intramucoso (compromiso de la lámina propia sin diseminación a la capa muscular de la mucosa). | |||
| T1 = tumor con invasión de la submucosa (a través de la capa muscular de la mucosa, pero no dentro de la capa muscular propia). | |||
| T2 = tumor con invasión de la capa muscular propia. | |||
| T3 = tumor con invasión de los tejidos pericolorrectales a través de la capa muscular propia. | |||
| T4 = tumor con invasión del peritoneo visceral, o con invasión y adherencia a un órgano o estructura adyacente. | |||
| –T4a = tumor con invasión del peritoneo visceral (incluso perforación macroscópica del intestino e invasión persistente de áreas inflamatorias en la superficie del peritoneo visceral). | |||
| –T4b = tumor con invasión directa o adherencia a órganos o estructuras adyacentes. | |||
| NX = ganglios linfáticos regionales no evaluables. | |||
| N0 = sin metástasis en ganglios linfáticos regionales. | |||
| N1 = compromiso de 1 a 3 ganglios linfáticos regionales (tumor en los ganglios linfáticos regionales que mide ≥0,2 mm), o cualquier cantidad de depósitos tumorales y todos los ganglios linfáticos identificables están libres de compromiso tumoral. | |||
| –N1a = compromiso de 1 ganglio linfático regional. | |||
| –N1b = compromiso de 2 o 3 ganglios linfáticos regionales. | |||
| –N1c = sin compromiso de ganglios linfáticos regionales, pero con depósitos tumorales en la subserosa, el mesenterio, los tejidos pericólicos no peritonealizados o en los tejidos perirrectales o mesorrectales. | |||
| N2 = compromiso de 4 o más ganglios linfáticos regionales. | |||
| –N2a = compromiso de 4 a 6 ganglios linfáticos regionales. | |||
| –N2b = compromiso de 7 o más ganglios linfáticos regionales. | |||
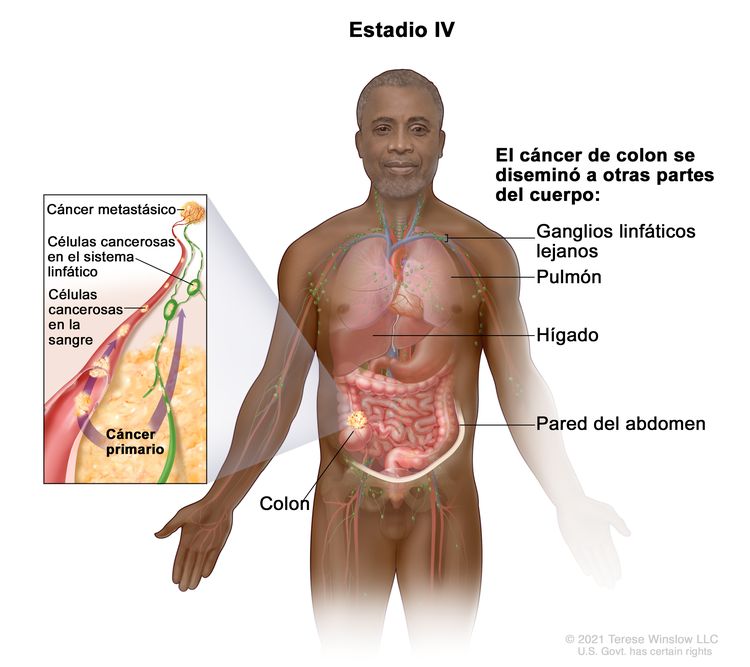
| M1a = se identifica metástasis en un sitio u órgano sin metástasis peritoneal. | |||
| IVB | Cualquier T, cualquier N, M1b | Cualquier T = consultar las descripciones de T en el grupo de estadio TNM para cualquier T, cualquier N, M1a. | |
| Cualquier N = consultar las descripciones de N en el grupo de estadio TNM para cualquier T, cualquier N1, M1a. | |||
| M1b = metástasis en 2 o más sitios u órganos sin metástasis peritoneal. | |||
| IVC | Cualquier T, cualquier N, M1c | Cualquier T = consultar las descripciones de T en el grupo de estadio TNM para cualquier T, cualquier N, M1a. | |
| Cualquier N = consultar las descripciones de N en el grupo de estadio TNM para cualquier T, cualquier N1, M1a. | |||
| M1c = se identifica metástasis en la superficie peritoneal, sola o con metástasis en otros sitios u órganos. | |||
References
- Jessup J, Benson A, Chen V: Colon and Rectum. In: Amin MB, Edge SB, Greene FL, et al., eds.: AJCC Cancer Staging Manual. 8th ed. Springer; 2017, pp 251–74.
- Compton CC, Greene FL: The staging of colorectal cancer: 2004 and beyond. CA Cancer J Clin 54 (6): 295-308, 2004 Nov-Dec.
- Nelson H, Petrelli N, Carlin A, et al.: Guidelines 2000 for colon and rectal cancer surgery. J Natl Cancer Inst 93 (8): 583-96, 2001.
- Swanson RS, Compton CC, Stewart AK, et al.: The prognosis of T3N0 colon cancer is dependent on the number of lymph nodes examined. Ann Surg Oncol 10 (1): 65-71, 2003 Jan-Feb.
- Le Voyer TE, Sigurdson ER, Hanlon AL, et al.: Colon cancer survival is associated with increasing number of lymph nodes analyzed: a secondary survey of intergroup trial INT-0089. J Clin Oncol 21 (15): 2912-9, 2003.
- Prandi M, Lionetto R, Bini A, et al.: Prognostic evaluation of stage B colon cancer patients is improved by an adequate lymphadenectomy: results of a secondary analysis of a large scale adjuvant trial. Ann Surg 235 (4): 458-63, 2002.
- Tepper JE, O'Connell MJ, Niedzwiecki D, et al.: Impact of number of nodes retrieved on outcome in patients with rectal cancer. J Clin Oncol 19 (1): 157-63, 2001.
Aspectos generales de las opciones de tratamiento del cáncer de colon
| Estadio (criterios de estadificación TNM) | Opciones de tratamiento estándar |
|---|---|
| Cáncer de colon en estadio 0 | Cirugía |
| Cáncer de colon en estadio l | Cirugía |
| Cáncer de colon en estadio II | Cirugía |
| Cáncer de colon en estadio III | Cirugía |
| Quimioterapia adyuvante |
| Estadio (criterios de estadificación TNM) | Opciones de tratamiento |
|---|---|
| Tratamiento de las metástasis hepáticas | Cirugía |
| Quimioterapia neoadyuvante | |
| Ablación local | |
| Quimioterapia adyuvante | |
| Quimioterapia intraarterial | |
| Tratamiento del cáncer de colon en estadio IV y recidivante | Cirugía |
| Terapia sistémica | |
| Inmunoterapia |
Tratamiento quirúrgico primario
El tratamiento estándar para los pacientes de cáncer de colon con enfermedad localizada es la resección quirúrgica abierta de los ganglios linfáticos primarios y regionales.
La función de las técnicas laparoscópicas para el tratamiento del cáncer de colon se evaluó en dos estudios.
Datos probatorios (técnicas laparoscópicas):
- En un ensayo multicéntrico prospectivo y aleatorizado de ausencia de inferioridad (NCCTG-934653 [NCT00002575]) se comparó la colectomía laparoscópica (CLA) y la colectomía abierta en 872 pacientes.
- Al cabo de una mediana de seguimiento de 4,4 años las tasas de recidiva a 3 años (16 % para CLA vs. 18 % para la colectomía abierta; cociente de riesgos instantáneos [CRI] para la recidiva, 0,86; intervalo de confianza [IC] 95 %, 0,63–1,17; P = 0,32) y las tasas de supervivencia general (SG) a 3 años (86 % para CLA vs. 85 % para la colectomía abierta; CRIde muerte para la CLA, 0,91; IC 95 %, 0,68–1,21; P = 0,51) fueron similares en ambos grupos para todos los estadios de la enfermedad evaluados. La recidiva tumoral en las incisiones quirúrgicas fue de menos del 1 % en ambos grupos.[Nivel de evidencia A1]
- Se informó disminución en la estadía hospitalaria (5 días para CLA vs. 6 días para la colectomía abierta P< 0,001) y disminución del uso de analgésicos en el grupo de CLA. Se observó que la tasa de conversión de CLA a un procedimiento abierto fue del 21 %.
- En este estudio se excluyeron a los pacientes con enfermedad localmente avanzada, tumores en el colon transverso y el recto, o lesiones perforadas. Cada uno de los 66 cirujanos que participaron en el ensayo habían realizado por lo menos 20 CLA y fueron acreditados para participar después de una revisión independiente por video para asegurar el uso uniforme de principios oncológicos y quirúrgicos. El componente sobre calidad de vida de este ensayo se publicó de manera separada y se notificaron beneficios mínimos a corto plazo para la calidad de vida en el grupo de CLA.[Nivel de evidencia A3]
- En un estudio aleatorizado pequeño de una sola institución llevado a cabo con 219 pacientes, en el análisis multivariante se observó que el procedimiento de CLA se relacionó de manera independiente con una disminución de la recidiva tumoral.[Nivel de evidencia A1]
En casos muy específicos, entre el 25 % y el 40 % de los pacientes con metástasis hepáticas y pulmonares resecables se curan mediante cirugía. Los avances en las técnicas quirúrgicas y las pruebas con imágenes preoperatorias permiten mejorar la selección de los pacientes para la resección.
Quimioterapia adyuvante
El posible valor de la quimioterapia adyuvante para los pacientes con cáncer de colon en estadio II es polémico. En análisis agrupados y metanálisis se indicó una mejoría del 2 % al 4 % para la SG de pacientes tratados con terapia adyuvante a base de fluorouracilo (5-FU) en comparación con observación. (Para obtener más información, consultar la sección de este sumario sobre Tratamiento del cáncer de colon en estadio II).
Antes del año 2000, el 5-FU era la única quimioterapia citotóxica útil en el entorno adyuvante para los pacientes de cáncer de colon en estadio III. Desde entonces, se estableció que la capecitabina es una opción equivalente al 5-FU y la leucovorina (5-FU y LV). Se observó que añadir oxaliplatino al tratamiento con 5-FU y LV mejora la SG en comparación con usar 5-FU y LV solos. (Para obtener más información, consultar la sección de este sumario sobre Tratamiento del cáncer de colon en estadio III).
Regímenes de quimioterapia
En el Cuadro 8 se describen los regímenes de quimioterapia utilizados para tratar el cáncer de colon.
| Nombre del régimen | Combinación farmacológica | Dosis |
|---|---|---|
| 5-FU = fluorouracilo; AIO = Arbeitsgemeinschaft Internistische Onkologie; IV = intravenoso; LV = leucovorina. | ||
| AIO o AIO alemán | Ácido fólico, 5-FU e irinotecán | Irinotecán (100 mg/m2) y LV (500 mg/m2) administrados en una infusión de 2 horas el día 1, seguidos de 5-FU (2000 mg/m2) en bolo IV administrado cada semana por bomba ambulatoria durante 24 horas, 4 veces por año (52 semanas). |
| CAPOX | Capecitabina y oxaliplatino | Capecitabina (1000 mg/m2) 2 veces al día los días 1–14 y oxaliplatino (70 mg/m2) los días 1 y 8 cada 3 semanas. |
| Douillard | Ácido fólico, 5-FU e irinotecán | Irinotecán (180 mg/m2) administrado en una infusión de 2 horas el día 1, LV (200 mg/m2) administrada en una infusión de 2 horas los días 1 y 2, seguida de una dosis de carga de 5-FU (400 mg/m2) en bolo IV, luego 5-FU (600 mg/m2) administrado por bomba ambulatoria durante 22 horas cada 2 semanas los días 1 y 2. |
| FOLFIRI | LV, 5-FU e irinotecán | Irinotecán (180 mg/m2) y LV (400 mg/m2) administrados en una infusión de 2 horas el día 1, seguidos de una dosis de carga de 5-FU (400 mg/m2) administrada en bolo IV el día 1, luego 5-FU (2400–3000 mg/m2) administrado por bomba ambulatoria durante 46 horas cada 2 semanas. |
| FOLFOX-4 | Oxaliplatino, LV y 5-FU | Oxaliplatino (85 mg/m2) administrado en una infusión de 2 horas el día 1, LV (200 mg/m2) administrada en una infusión de 2 horas los días 1 y 2, seguida de una dosis de carga de 5-FU (400 mg/m2) en bolo IV, luego 5-FU (600 mg/m2) administrado por bomba ambulatoria durante 22 horas cada 2 semanas los días 1 y 2. |
| FOLFOX-6 | Oxaliplatino, LV y 5-FU | Oxaliplatino (85–100 mg/m2) y LV (400 mg/m2) administrados en una infusión de 2 horas el día 1, seguidos de una dosis de carga de 5-FU (400 mg/m2) en bolo IV el día 1, luego 5-FU (2400–3000 mg/m2) administrado por bomba ambulatoria durante 46 horas cada 2 semanas. |
| FOLFOXIRI | Irinotecán, oxaliplatino, LV y 5-FU | Irinotecán (165 mg/m2) administrado en una infusión de 60 minutos, luego se administra una infusión simultánea de oxaliplatino (85 mg/m2) y LV (200 mg/m2) durante 120 minutos, seguidos de 5-FU (3200 mg/m2) administrado en una infusión continua durante 48 horas. |
| FUFOX | 5-FU, LV y oxaliplatino | Oxaliplatino (50 mg/m2), LV (500 mg/m2) y 5-FU (2000 mg/m2) administrados en una infusión continua durante 22 horas los días 1, 8, 22 y 29 cada 36 días. |
| FUOX | 5-FU y oxaliplatino | 5-FU (2250 mg/m2) administrados en una infusión continua durante 48 horas los días 1, 8, 15, 22, 29 y 36, junto con oxaliplatino (85 mg/m2) los días 1, 15 y 29 cada 6 semanas. |
| IFL (o Saltz) | Irinotecán, 5-FU y LV | Irinotecán (125 mg/m2) y 5-FU (500 mg/m2) en bolo IV, con LV (20 mg/m2) en bolo IV administrada cada semana durante 4 de 6 semanas. |
| XELOX | Capecitabina y oxaliplatino | Capecitabina oral (1000 mg/m2) administrada 2 veces al día durante 14 días y oxaliplatino (130 mg/m2) el día 1 cada 3 semanas. |
Radioterapia adyuvante
Aunque el tratamiento de modalidad combinada con quimioterapia y radioterapia tiene una función importante para la atención de pacientes con cáncer de recto (por debajo de la reflexión peritoneal), la función de la radioterapia adyuvante para los pacientes con cáncer de colon (por encima de la reflexión peritoneal) no está bien definida. Los análisis de modelos de atención y revisiones retrospectivas de una sola institución indican que la radioterapia cumple una función para ciertos subgrupos de pacientes con cáncer de colon de riesgo alto (por ejemplo, T4, ubicación del tumor en sitios inmóviles, perforación local, obstrucción y enfermedad residual después de la resección).
Datos probatorios (radioterapia adyuvante):
- Estas observaciones llevaron a plantear un estudio aleatorizado intergrupal de fase III diseñado para probar el beneficio de añadir radioterapia a la cirugía y la quimioterapia con 5-FU y levamisol para determinados pacientes con cáncer de colon de riesgo alto (por ejemplo, T4 o T3, N1–N2 en el colon ascendente o descendente).
- Este ensayo clínico se cerró de manera anticipada por insuficiente inclusión de pacientes; en el análisis de los 222 participantes (la meta original fue de 700 pacientes) no se observó beneficio relacionado con la recidiva o la SG para el grupo que recibió radioterapia, aunque el tamaño de la muestra y la potencia estadística resultaron inadecuados para excluir algún beneficio.
En la actualidad, la radioterapia adyuvante no cumple ninguna función estándar durante el tratamiento de los pacientes con cáncer de colon después de una resección curativa, aunque puede desempeñar alguna función en los pacientes con enfermedad residual.
References
- Bokey EL, Moore JW, Chapuis PH, et al.: Morbidity and mortality following laparoscopic-assisted right hemicolectomy for cancer. Dis Colon Rectum 39 (10 Suppl): S24-8, 1996.
- Franklin ME, Rosenthal D, Abrego-Medina D, et al.: Prospective comparison of open vs. laparoscopic colon surgery for carcinoma. Five-year results. Dis Colon Rectum 39 (10 Suppl): S35-46, 1996.
- Fleshman JW, Nelson H, Peters WR, et al.: Early results of laparoscopic surgery for colorectal cancer. Retrospective analysis of 372 patients treated by Clinical Outcomes of Surgical Therapy (COST) Study Group. Dis Colon Rectum 39 (10 Suppl): S53-8, 1996.
- Schwenk W, Böhm B, Müller JM: Postoperative pain and fatigue after laparoscopic or conventional colorectal resections. A prospective randomized trial. Surg Endosc 12 (9): 1131-6, 1998.
- Clinical Outcomes of Surgical Therapy Study Group: A comparison of laparoscopically assisted and open colectomy for colon cancer. N Engl J Med 350 (20): 2050-9, 2004.
- Weeks JC, Nelson H, Gelber S, et al.: Short-term quality-of-life outcomes following laparoscopic-assisted colectomy vs open colectomy for colon cancer: a randomized trial. JAMA 287 (3): 321-8, 2002.
- Lacy AM, García-Valdecasas JC, Delgado S, et al.: Laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomised trial. Lancet 359 (9325): 2224-9, 2002.
- Efficacy of adjuvant fluorouracil and folinic acid in B2 colon cancer. International Multicentre Pooled Analysis of B2 Colon Cancer Trials (IMPACT B2) Investigators. J Clin Oncol 17 (5): 1356-63, 1999.
- Gill S, Loprinzi CL, Sargent DJ, et al.: Pooled analysis of fluorouracil-based adjuvant therapy for stage II and III colon cancer: who benefits and by how much? J Clin Oncol 22 (10): 1797-806, 2004.
- Mamounas E, Wieand S, Wolmark N, et al.: Comparative efficacy of adjuvant chemotherapy in patients with Dukes' B versus Dukes' C colon cancer: results from four National Surgical Adjuvant Breast and Bowel Project adjuvant studies (C-01, C-02, C-03, and C-04) J Clin Oncol 17 (5): 1349-55, 1999.
- Willett C, Tepper JE, Cohen A, et al.: Local failure following curative resection of colonic adenocarcinoma. Int J Radiat Oncol Biol Phys 10 (5): 645-51, 1984.
- Willett C, Tepper JE, Cohen A, et al.: Obstructive and perforative colonic carcinoma: patterns of failure. J Clin Oncol 3 (3): 379-84, 1985.
- Gunderson LL, Sosin H, Levitt S: Extrapelvic colon--areas of failure in a reoperation series: implications for adjuvant therapy. Int J Radiat Oncol Biol Phys 11 (4): 731-41, 1985.
- Willett CG, Fung CY, Kaufman DS, et al.: Postoperative radiation therapy for high-risk colon carcinoma. J Clin Oncol 11 (6): 1112-7, 1993.
- Willett CG, Goldberg S, Shellito PC, et al.: Does postoperative irradiation play a role in the adjuvant therapy of stage T4 colon cancer? Cancer J Sci Am 5 (4): 242-7, 1999 Jul-Aug.
- Schild SE, Gunderson LL, Haddock MG, et al.: The treatment of locally advanced colon cancer. Int J Radiat Oncol Biol Phys 37 (1): 51-8, 1997.
- Martenson JA, Willett CG, Sargent DJ, et al.: Phase III study of adjuvant chemotherapy and radiation therapy compared with chemotherapy alone in the surgical adjuvant treatment of colon cancer: results of intergroup protocol 0130. J Clin Oncol 22 (16): 3277-83, 2004.
Tratamiento del cáncer de colon en estadio 0
El cáncer de colon en estadio 0 es el tipo de lesión más superficial y se limita a la mucosa sin invasión de la lámina propia. Debido a que es superficial, el procedimiento quirúrgico puede ser limitado.
Opciones de tratamiento estándar del cáncer de colon en estadio 0
Cirugía
Las opciones de tratamiento estándar del cáncer de colon en estadio 0 son las siguientes:
- Extirpación local o polipectomía simple con márgenes limpios.
- Resección del colon para lesiones más grandes que no son susceptibles de extirpación local.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
stage I colon cancerTratamiento del cáncer de colon en estadio l
Debido a que es localizado, el cáncer de colon en estadio I tiene una tasa de curación alta.
Opciones de tratamiento estándar del cáncer de colon en estadio l
Cirugía
Las opciones de tratamiento estándar del cáncer de colon en estadio l son las siguientes:
- Resección quirúrgica amplia y anastomosis.
Datos probatorios (técnicas laparoscópicas):
La función de las técnicas laparoscópicas para el tratamiento del cáncer de colon se examinó en un ensayo aleatorizado prospectivo multicéntrico (NCCTG-934653 [NCT00002575]) en el que se comparó la colectomía laparoscópica (CLA) y la colectomía abierta.
- Las tasas de recidiva a 3 años y las tasas de supervivencia general a 3 años fueron similares en ambos grupos. (Para obtener más información, consultar la sección sobre Tratamiento quirúrgico primario en la sección de este sumario sobre Aspectos generales de las opciones de tratamiento del cáncer de colon).
- El componente sobre calidad de vida de este ensayo se publicó de manera separada y se notificaron beneficios mínimos a corto plazo para la calidad de vida en el grupo de CLA.[Nivel de evidencia A3]
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
References
- Bokey EL, Moore JW, Chapuis PH, et al.: Morbidity and mortality following laparoscopic-assisted right hemicolectomy for cancer. Dis Colon Rectum 39 (10 Suppl): S24-8, 1996.
- Franklin ME, Rosenthal D, Abrego-Medina D, et al.: Prospective comparison of open vs. laparoscopic colon surgery for carcinoma. Five-year results. Dis Colon Rectum 39 (10 Suppl): S35-46, 1996.
- Fleshman JW, Nelson H, Peters WR, et al.: Early results of laparoscopic surgery for colorectal cancer. Retrospective analysis of 372 patients treated by Clinical Outcomes of Surgical Therapy (COST) Study Group. Dis Colon Rectum 39 (10 Suppl): S53-8, 1996.
- Schwenk W, Böhm B, Müller JM: Postoperative pain and fatigue after laparoscopic or conventional colorectal resections. A prospective randomized trial. Surg Endosc 12 (9): 1131-6, 1998.
- Weeks JC, Nelson H, Gelber S, et al.: Short-term quality-of-life outcomes following laparoscopic-assisted colectomy vs open colectomy for colon cancer: a randomized trial. JAMA 287 (3): 321-8, 2002.
Tratamiento del cáncer de colon en estadio II
Opciones de tratamiento estándar del cáncer de colon en estadio II
Cirugía
Las opciones de tratamiento estándar del cáncer de colon en estadio II son las siguientes:
- Resección quirúrgica amplia y anastomosis.
Datos probatorios (técnicas laparoscópicas):
La función de las técnicas laparoscópicas para el tratamiento del cáncer de colon se examinó en un ensayo aleatorizado prospectivo multicéntrico (NCCTG-934653 [NCT00002575]) en el que se comparó la colectomía laparoscópica (CLA) y la colectomía abierta.
- Las tasas de recidiva a 3 años y las tasas de supervivencia general (SG) a 3 años fueron similares en ambos grupos. (Para obtener más información, consultar la sección sobre Tratamiento quirúrgico primario en la sección de este sumario sobre Aspectos generales de las opciones de tratamiento del cáncer de colon).
- El componente sobre calidad de vida de este ensayo se publicó de manera separada y se notificaron beneficios mínimos a corto plazo para la calidad de vida en el grupo de CLA.[Nivel de evidencia A3]
Opciones de tratamiento en evaluación clínica
Quimioterapia adyuvante
El posible valor de la quimioterapia adyuvante para los pacientes con cáncer de colon en estadio II es polémico. Aunque es posible que determinados subgrupos de pacientes con cáncer de colon en estadio II tengan un riesgo de recidiva superior al promedio (incluso aquellos con características anatómicas como adherencia tumoral a estructuras adyacentes, perforación y obstrucción completa), los datos probatorios son contradictorios sobre la quimioterapia de fluorouracilo (5-FU) y su relación con una mejora de la SG en comparación con la cirugía sola.
Las características de los pacientes con cáncer de colon en estadio II que se vinculan con un aumento del riesgo de recidiva incluyen los siguientes aspectos:
- Muestra inadecuada de ganglios linfáticos.
- Enfermedad T4.
- Compromiso del peritoneo visceral.
- Tipo histológico con diferenciación precaria.
La decisión de utilizar quimioterapia adyuvante para los pacientes con cáncer de colon en estadio II es complicada y exige un análisis cuidadoso por parte de los pacientes y sus médicos. Para la mayoría de los pacientes no se indica la terapia adyuvante a menos que participen en un ensayo clínico.
Datos probatorios (quimioterapia adyuvante):
- En los ensayos GRECCR-03 (NCT00046995) y NCRI-QUASAR1 (NCT00005586) se evaluó el uso de quimioterapia sistémica, quimioterapia regional y terapia biológica. Después de la cirugía, los pacientes deben analizar la posibilidad de participar en un ensayo clínico controlado estricto.
- Los investigadores del National Surgical Adjuvant Breast and Bowel Project indicaron que, para la terapia adyuvante, la reducción del riesgo de recidiva en los pacientes con enfermedad en estadio II es de una magnitud semejante al beneficio observado en los pacientes con enfermedad en estadio III, aunque no se ha establecido una ventaja para la SG.
- En un metanálisis de una serie de ensayos en el que se combinaron las experiencias de 1000 pacientes en estadio II, se indica que hay una ventaja del 2 % en la supervivencia sin enfermedad a 5 años de los pacientes sometidos a terapia adyuvante con 5-FU y leucovorina, en comparación con los pacientes del grupo de control que no recibieron tratamiento.[Nivel de evidencia B1];
- El Cancer Care Ontario Practice Guideline Initiative Gastrointestinal Cancer Disease Site Group llevó a cabo un metanálisis de la literatura publicada en inglés sobre ensayos aleatorizados en los que se comparó la quimioterapia adyuvante y la observación para pacientes con cáncer de colon en estadio II.
- El cociente de riesgos de mortalidad fue de 0,87 (intervalo de confianza 95 %, 0,75–1,01; P = 0,07).
A partir de estos datos, la American Society of Clinical Oncology formuló una directriz en la que indica “los datos probatorios de los ensayos controlados aleatorizados no sustentan el uso habitual de la quimioterapia adyuvante para los pacientes con cáncer de colon en estadio II”.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
References
- Bokey EL, Moore JW, Chapuis PH, et al.: Morbidity and mortality following laparoscopic-assisted right hemicolectomy for cancer. Dis Colon Rectum 39 (10 Suppl): S24-8, 1996.
- Franklin ME, Rosenthal D, Abrego-Medina D, et al.: Prospective comparison of open vs. laparoscopic colon surgery for carcinoma. Five-year results. Dis Colon Rectum 39 (10 Suppl): S35-46, 1996.
- Fleshman JW, Nelson H, Peters WR, et al.: Early results of laparoscopic surgery for colorectal cancer. Retrospective analysis of 372 patients treated by Clinical Outcomes of Surgical Therapy (COST) Study Group. Dis Colon Rectum 39 (10 Suppl): S53-8, 1996.
- Weeks JC, Nelson H, Gelber S, et al.: Short-term quality-of-life outcomes following laparoscopic-assisted colectomy vs open colectomy for colon cancer: a randomized trial. JAMA 287 (3): 321-8, 2002.
- Lanza G, Matteuzzi M, Gafá R, et al.: Chromosome 18q allelic loss and prognosis in stage II and III colon cancer. Int J Cancer 79 (4): 390-5, 1998.
- Jen J, Kim H, Piantadosi S, et al.: Allelic loss of chromosome 18q and prognosis in colorectal cancer. N Engl J Med 331 (4): 213-21, 1994.
- Merkel S, Wein A, Günther K, et al.: High-risk groups of patients with Stage II colon carcinoma. Cancer 92 (6): 1435-43, 2001.
- Moertel CG, Fleming TR, Macdonald JS, et al.: Intergroup study of fluorouracil plus levamisole as adjuvant therapy for stage II/Dukes' B2 colon cancer. J Clin Oncol 13 (12): 2936-43, 1995.
- Mamounas E, Wieand S, Wolmark N, et al.: Comparative efficacy of adjuvant chemotherapy in patients with Dukes' B versus Dukes' C colon cancer: results from four National Surgical Adjuvant Breast and Bowel Project adjuvant studies (C-01, C-02, C-03, and C-04) J Clin Oncol 17 (5): 1349-55, 1999.
- Efficacy of adjuvant fluorouracil and folinic acid in B2 colon cancer. International Multicentre Pooled Analysis of B2 Colon Cancer Trials (IMPACT B2) Investigators. J Clin Oncol 17 (5): 1356-63, 1999.
- Harrington DP: The tea leaves of small trials. J Clin Oncol 17 (5): 1336-8, 1999.
- Figueredo A, Charette ML, Maroun J, et al.: Adjuvant therapy for stage II colon cancer: a systematic review from the Cancer Care Ontario Program in evidence-based care's gastrointestinal cancer disease site group. J Clin Oncol 22 (16): 3395-407, 2004.
- Benson AB, Schrag D, Somerfield MR, et al.: American Society of Clinical Oncology recommendations on adjuvant chemotherapy for stage II colon cancer. J Clin Oncol 22 (16): 3408-19, 2004.
Tratamiento del cáncer de colon en estadio III
En el cáncer de colon en estadio III hay compromiso ganglionar. En los estudios se indicó que el número de ganglios linfáticos comprometidos afecta el pronóstico; los pacientes con compromiso de 1 a 3 ganglios linfáticos tienen una supervivencia significativamente mejor que los pacientes con compromiso de 4 o más ganglios.
Opciones de tratamiento estándar del cáncer de colon en estadio III
Las opciones de tratamiento estándar del cáncer de colon en estadio III son las siguientes:
- Cirugía.
- Quimioterapia adyuvante.
Cirugía
Para el cáncer de colon en estadio III, se indica resección quirúrgica amplia y anastomosis.
Datos probatorios (técnicas laparoscópicas):
La función de las técnicas laparoscópicas para el tratamiento del cáncer de colon se examinó en un ensayo aleatorizado prospectivo multicéntrico (NCCTG-934653 [NCT00002575]) en el que se comparó la colectomía laparoscópica (CLA) y la colectomía abierta.
- Las tasas de recidiva a 3 años y las tasas de supervivencia general (SG) a 3 años fueron similares en ambos grupos. (Para obtener más información, consultar la sección sobre Tratamiento quirúrgico primario en la sección de este sumario sobre Aspectos generales de las opciones de tratamiento del cáncer de colon).
- El componente sobre calidad de vida de este ensayo se publicó de manera separada y se notificaron beneficios mínimos a corto plazo para la calidad de vida en el grupo de CLA.[Nivel de evidencia A3]
Quimioterapia adyuvante
Regímenes quimioterapéuticos antes del año 2000
Antes del año 2000, el fluorouracilo (5-FU) era la única quimioterapia citotóxica disponible en el entorno adyuvante para pacientes con cáncer de colon en estadio III. En muchos de los estudios aleatorizados iniciales sobre 5-FU para el entorno adyuvante no se logró demostrar una mejora significativa en la supervivencia de los pacientes. En estos ensayos se usó 5-FU solo o 5-FU con semustina.
Datos probatorios (5-FU solo y 5-FU con semustina):
- El North Central Cancer Treatment Group condujo un ensayo aleatorizado en el que la resección quirúrgica sola se comparó con la administración posoperatoria de levamisol o levamisol con 5-FU.[Nivel de evidencia A1]
- Se observó una mejoría significativa en la supervivencia sin enfermedad (SSE) de los pacientes con cáncer de colon en estadio III que recibieron levamisol y 5-FU, pero el beneficio para la SG se ubicó en el límite de significación estadística.
- Se observó un beneficio absoluto para la supervivencia de alrededor de 12 % (49 vs. 37 %) en los pacientes con enfermedad en estadio III tratados con levamisol y 5-FU.
- En un gran ensayo intergrupal confirmatorio, la administración de levamisol y 5-FU prolongó la SSE y la SG de los pacientes con cáncer de colon en estadio III en comparación con los pacientes que no recibieron tratamiento después de la cirugía.[Nivel de evidencia A1] El uso de levamisol solo no produjo estos beneficios.
- En estudios posteriores se probó la combinación de 5-FU y leucovorina (5-FU y LV) para el tratamiento adyuvante de los pacientes con carcinoma de colon resecado.
- En los resultados de ensayos aleatorizados múltiples con inscripción de más de 4000 pacientes en los que se comparó la quimioterapia adyuvante de 5-FU y LV con cirugía o la administración de 5-FU, semustina y vincristina, se observó una reducción relativa de la mortalidad del 22 % al 33 % (la SG a 3 años de 71–78 % aumentó hasta 75–84 %).
- En el ensayo intergrupal 0089 (INT-0089 [NCT00201331]), que ya se completó, 3794 pacientes con cáncer de colon de riesgo alto en estadios II o III se asignaron al azar a uno de cuatro grupos de tratamiento:
- Administración del régimen de la Mayo Clinic durante 6 ciclos.
- Administración del régimen del Roswell Park durante 4 ciclos.
- Administración del régimen de la Mayo Clinic con levamisol durante 6 ciclos.
- Administración un régimen de levamisol durante 1 año.
Resultados:
- La SG a 5 años osciló entre el 49 % para el régimen de la Mayo Clinic con levamisol y el 60 % para el régimen de la Mayo Clinic; no hubo diferencias estadísticamente significativas entre los grupos de tratamiento.[Nivel de evidencia A1]
- En un informe preliminar de noviembre de 1997, se observó una ventaja estadísticamente significativa de la SG para el régimen de la Mayo Clinic con levamisol en comparación con el régimen de levamisol. Esta diferencia se tornó insignificante al prolongar el seguimiento.
- En general, se presentaron con mayor frecuencia efectos tóxicos de grado 3 o más altos durante el régimen de la Mayo Clinic y el régimen de la Mayo Clinic con levamisol. Además, el régimen de la Mayo Clinic con levamisol fue significativamente más tóxico cuando se acompañó de levamisol, en comparación con el régimen sin levamisol.
- La tasa de mortalidad para los cuatro regímenes osciló entre el 0,5 % y el 1 %.
- Debido a la facilidad de uso y su perfil de toxicidad favorable, el régimen del Roswell Park se convirtió en el régimen adyuvante preferido en los Estados Unidos y se usó con frecuencia para el grupo de control en los ensayos aleatorizados subsiguientes.
- Además del ensayo INT-0089, a continuación, se resumen las conclusiones de varios estudios en los que se refinó el uso de 5-FU y LV para el entorno adyuvante:
- El levamisol es innecesario cuando se usa leucovorina.
- El tratamiento con 5-FU y LV durante 6 a 8 meses es equivalente al tratamiento durante 12 meses.
- El tratamiento con 5-FU y LV durante 24 semanas es equivalente al tratamiento durante 36 semanas.
- Las dosis altas de leucovorina son equivalentes a las dosis bajas de leucovorina.
- En un metanálisis de 7 ensayos no se encontraron diferencias significativas en la eficacia o la toxicidad para los pacientes de 70 años o menos en comparación con los pacientes mayores de 70 años.
- Es más inocuo administrar un bolo de Gramont en infusión y un programa de 5-FU y LV en infusión que un bolo modificado de 5-FU y LV del régimen de la Mayo Clinic.
Regímenes quimioterapéuticos después del año 2000
Capecitabina
La capecitabina es una fluoropirimidina oral que pasa por una conversión enzimática de tres pasos y se convierte en 5-FU durante el paso final en la célula tumoral. En dos estudios se demostró la equivalencia de la capecitabina y el 5-FU con LV para los pacientes con cáncer de colon metastásico.
Para los pacientes con cáncer de colon en estadio III, la capecitabina proporciona desenlaces equivalentes al 5-FU y LV intravenosos.
Datos probatorios (capecitabina):
- En un estudio multicéntrico europeo se comparó la capecitabina (1250 mg/m2 administrada 2 veces al día durante los días 1 a 14, y luego cada 21 días durante 8 ciclos con el régimen de la Mayo Clinic de 5-FU y dosis bajas de LV para pacientes con cáncer de colon en estadio III.
- En el estudio se demostró que la SSE a 3 años es equivalente para los pacientes que recibieron capecitabina o 5-FU con LV (cociente de riesgos instantáneos [CRI] = 0,87; P< 0,001).[Nivel de evidencia B1]
- La eritrodisestesia palmoplantar y la hiperbilirrubinemia fueron significativamente más frecuentes en los pacientes que recibieron la capecitabina, pero la diarrea, las náuseas o los vómitos, la estomatitis, la alopecia y la neutropenia fueron significativamente menos frecuentes.
- De los pacientes que recibieron la capecitabina, 57 % necesitaron una modificación de la dosis.
- La capecitabina es una opción equivalente para los pacientes con cáncer de colon en estadio III en quienes se prevé un tratamiento con 5-FU y LV.
Oxaliplatino
El oxaliplatino tiene una actividad importante cuando se combina con 5-FU y LV en pacientes de cáncer colorrectal metastásico.
Datos probatorios (oxaliplatino):
- En el estudio Multicenter International Study of Oxaliplatin/Fluorouracil/Leucovorin in the Adjuvant Treatment of Colon Cancer (MOSAIC [NCT00275210]) ya completado con 2246 pacientes de cáncer de colon en estadio II o estadio III sometidos a resección, se encontró que los efectos tóxicos y la eficacia de FOLFOX-4 (oxaliplatino, LV y 5-FU) fueron comparables a los del mismo régimen de 5-FU y LV sin oxaliplatino administrado durante 6 meses. En los resultados del ensayo MOSAIC se determinó que FOLFOX-4 adyuvante prolongó la SG de los pacientes con cáncer de colon en estadio III en comparación con los pacientes que recibieron 5-FU y LV sin oxaliplatino.
- En los resultados preliminares del estudio llevados a cabo a los 37 meses de seguimiento se observó una mejoría significativa en la SSE a 3 años (77,8 vs. 72,9 %; P = 0,01) a favor del FOLFOX-4. En el primer informe no se notificó diferencia en la SG.[Nivel de evidencia B1]
- En un seguimiento posterior llevado a cabo a los 6 años se notificó que la SG para todos los pacientes (en estadio II y estadio III) que participaron en el estudio no fue estadísticamente diferente (SG, 78,5 vs. 76,0 %; CRI = 0,84; intervalo de confianza [IC] 95 %, 0,71–1,00). En un análisis de subconjuntos, la SG a 6 años de los pacientes con cáncer de colon en estadio III fue del 72,9 % en los que recibieron FOLFOX-4 y del 68,7 % en los que recibieron 5-FU y LV (CRI = 0,80; IC 95 %, 0,65–0,97; P = 0,023).[Nivel de evidencia A1]
- Los pacientes tratados con FOLFOX-4 presentaron efectos tóxicos más frecuentes, principalmente neutropenia (41 % > grado 3) y neuropatía sensitiva periférica reversible (12,4 % > grado 3).
- En un estudio aleatorizado de fase III (NSABP C-07 [NCT00004931]), se asignaron al azar 2407 pacientes de cáncer de colon en estadio II o III para recibir terapia adyuvante con 5-FU y LV o fluorouracilo, leucovorina y oxaliplatino (FLOX) (5-FU y LV semanal con administración de oxaliplatino en las semanas 1, 3 y 5 de cada ciclo de 6 semanas). La SSE fue el criterio principal de valoración del estudio.
- La SSE fue significativamente más larga en el grupo de tratamiento que recibió FLOX, pero no hubo diferencias significativas en la SG. La tasa de SSE fue del 69,4 % para los pacientes que recibieron FLOX, y del 64,2 % para los pacientes que recibieron 5-FU y LV (CRI = 0,82; IC 95 %, 0,72–0,93; P = 0,0034).
- La tasa de SG a 5 años fue del 80,2 % para los pacientes que recibieron FLOX y del 78,4 % para los pacientes que recibieron 5-FU y LV (CRI = 0,88; IC 95 %, 0,75–1,02; P = 0,08).[Nivel de evidencia B1]
- Entre los pacientes que recibieron FLOX, el 36,9 % presentó diarrea de grado 3 y 4, y el 16,1 % experimentó deshidratación de grado 3 y 4.
La mayoría de los médicos han adoptado el régimen FOLFOX como el tratamiento estándar debido a las preocupaciones sobre la toxicidad del FLOX semanal. FOLFOX se ha convertido en el estándar de referencia para la próxima generación de ensayos clínicos de pacientes con cáncer de colon en estadio III.
Capecitabina y oxaliplatino
La combinación de capecitabina y oxaliplatino (CAPOX) es un tratamiento estándar aceptado para pacientes con cáncer de colon metastásico.
Datos probatorios (CAPOX):
- Se evaluó CAPOX en el entorno adyuvante para pacientes con cáncer de colon en estadio III sometidos a resección (1000 mg/m2 de capecitabina 2 veces al día, los días 1 a 14 cada 21 días, y 130 mg/m2 de oxaliplatino cada 21 días durante 8 ciclos). En un ensayo aleatorizado de fase III (NO16968 [NCT00069121]), se asignaron al azar 1886 pacientes de cáncer de colon en estadio III para recibir CAPOX o 5FU y LV en bolo (régimen del Roswell Park o de la Mayo Clinic).
- La tasa de SSE a 7 años fue del 63 % para los pacientes que recibieron CAPOX y del 56 % para los pacientes que recibieron 5-FU y LV en bolo (CRI = 0,8; IC 95 %, 0,69–0,93; P = 0,004).
- La tasa de SG a 7 años fue del 73 % para los pacientes que recibieron CAPOX y del 67 % para los pacientes que recibieron 5-FU y LV en bolo (CRI = 0,83; IC 95 %, 0,70–0,99; P = 0,04).[Nivel de evidencia A1]
De acuerdo con este ensayo, CAPOX se ha convertido en un régimen estándar aceptable para los pacientes de cáncer de colon en estadio III.
Duración de la terapia con oxaliplatino
La duración de la terapia adyuvante con oxaliplatino se ha vuelto un tema de debate debido a la tasa elevada de neuropatía incapacitante.
Datos probatorios (duración de la terapia con oxaliplatino):
- La colaboración International Duration Evaluation of Adjuvant Therapy (IDEA) consistió en 6 ensayos aleatorizados independientes sobre comparación de regímenes de 6 y 3 meses de quimioterapia adyuvante con oxaliplatino. El estudio IDEA fue un análisis prospectivo combinado y planificado con anterioridad de estos estudios realizados de manera simultánea, cuyo objetivo fue evaluar la ausencia de inferioridad de la terapia adyuvante de FOLFOX o CAPOX administrados durante 3 o 6 meses. Se podría afirmar la ausencia de inferioridad si el límite superior del IC de 95 % bilateral del CRI no fuera mayor a 1,12.
Desde junio de 2007 hasta diciembre de 2015, se inscribieron 13 025 pacientes de cáncer de colon en estadio III en 6 ensayos simultáneos de fase III. De esos pacientes, 12 834 cumplieron los criterios del análisis por intención de tratar. Al cabo de una mediana de seguimiento de 41,8 meses, no se confirmó la ausencia de inferioridad del régimen de 3 meses en comparación con el régimen de 6 meses en el análisis de la población por intención de tratar modificado (CRI = 1,07; IC 95 %, 1,00–1,15; P = 0,11 para la ausencia de inferioridad de 3 meses).
- La tasa de SSE a 3 años fue del 74,6 % para el grupo de 3 meses y del 75,5 % para el grupo de 6 meses.
- La neurotoxicidad de grado 2 o más, fue inferior en el grupo de 3 meses (un 16,6 % para los pacientes que recibieron FOLFOX y un 14,2 % para los pacientes que recibieron CAPOX) que en el grupo de 6 meses (un 47,7 % para los pacientes que recibieron FOLFOX y un 44,9 % para los pacientes que recibieron CAPOX). Más aún, el resto de efectos tóxicos fueron mucho más bajos con el tratamiento de 3 meses que con el de 6 meses.
- En un análisis de subgrupos se observaron los siguientes aspectos:
- Entre los pacientes que recibieron FOLFOX, la terapia de 6 meses fue superior a la de 3 meses (CRI = 1,16; IC 95 %, 1,06–1,26; P = 0,001).
- Entre los pacientes que recibieron CAPOX, la terapia de 3 meses fue igual a la de 6 meses (CRI para SSE = 0,95; IC 95 %, 0,85–1,06) y se cumplió con el margen predeterminado para la ausencia de inferioridad.
- Entre los pacientes con tumores N1 (compromiso de <4 ganglios), el CRI fue de 1,07 (0,97–1,17), y entre los pacientes con tumores N2 (compromiso de ≥4 ganglios), el CRI fue de 1,07 (0,96–1,19).
- Entre los pacientes con tumores T4, una terapia de 3 meses de duración fue inferior a una de 6 meses de duración (CRI = 1,16; IC 95 %, 1,03–1,31).
- Entre los pacientes con tumores de riesgo bajo (T1–3, N1), la terapia de 3 meses de duración no fue inferior a la terapia de 6 meses (CRI = 1,01; IC 95 %, 0,90–1,12) y la tasa de SSE a 3 años fue del 83,1 % para los pacientes que recibieron 3 meses de terapia y del 83,3 % para los pacientes que recibieron 6 meses de terapia.
- Entre los pacientes con tumores de riesgo alto (T4 o N2), la terapia de 6 meses fue superior a la terapia de 3 meses (CRI = 1,12; IC 95 %, 1,03–1,23; P = 0,01).
El estudio IDEA ha generado mucho debate acerca de la duración óptima del tratamiento. Se recomienda que los pacientes y los médicos evalúen las ventajas y desventajas de una posible eficacia reducida del tratamiento de 3 meses frente a un aumento definitivo del riesgo de toxicidad, en especial de la neuropatía. CAPOX parece ser un poco más activo que FOLFOX en el entorno adyuvante.
Opciones de tratamiento en evaluación clínica
Los pacientes aptos deben analizar la posibilidad de participar en ensayos clínicos controlados estrictos en los que se comparen varios regímenes de quimioterapia posoperatorios.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
References
- Bokey EL, Moore JW, Chapuis PH, et al.: Morbidity and mortality following laparoscopic-assisted right hemicolectomy for cancer. Dis Colon Rectum 39 (10 Suppl): S24-8, 1996.
- Franklin ME, Rosenthal D, Abrego-Medina D, et al.: Prospective comparison of open vs. laparoscopic colon surgery for carcinoma. Five-year results. Dis Colon Rectum 39 (10 Suppl): S35-46, 1996.
- Fleshman JW, Nelson H, Peters WR, et al.: Early results of laparoscopic surgery for colorectal cancer. Retrospective analysis of 372 patients treated by Clinical Outcomes of Surgical Therapy (COST) Study Group. Dis Colon Rectum 39 (10 Suppl): S53-8, 1996.
- Schwenk W, Böhm B, Müller JM: Postoperative pain and fatigue after laparoscopic or conventional colorectal resections. A prospective randomized trial. Surg Endosc 12 (9): 1131-6, 1998.
- Weeks JC, Nelson H, Gelber S, et al.: Short-term quality-of-life outcomes following laparoscopic-assisted colectomy vs open colectomy for colon cancer: a randomized trial. JAMA 287 (3): 321-8, 2002.
- Panettiere FJ, Goodman PJ, Costanzi JJ, et al.: Adjuvant therapy in large bowel adenocarcinoma: long-term results of a Southwest Oncology Group Study. J Clin Oncol 6 (6): 947-54, 1988.
- Adjuvant therapy of colon cancer--results of a prospectively randomized trial. Gastrointestinal Tumor Study Group. N Engl J Med 310 (12): 737-43, 1984.
- Higgins GA, Amadeo JH, McElhinney J, et al.: Efficacy of prolonged intermittent therapy with combined 5-fluorouracil and methyl-CCNU following resection for carcinoma of the large bowel. A Veterans Administration Surgical Oncology Group report. Cancer 53 (1): 1-8, 1984.
- Buyse M, Zeleniuch-Jacquotte A, Chalmers TC: Adjuvant therapy of colorectal cancer. Why we still don't know. JAMA 259 (24): 3571-8, 1988.
- Laurie JA, Moertel CG, Fleming TR, et al.: Surgical adjuvant therapy of large-bowel carcinoma: an evaluation of levamisole and the combination of levamisole and fluorouracil. The North Central Cancer Treatment Group and the Mayo Clinic. J Clin Oncol 7 (10): 1447-56, 1989.
- Moertel CG, Fleming TR, Macdonald JS, et al.: Levamisole and fluorouracil for adjuvant therapy of resected colon carcinoma. N Engl J Med 322 (6): 352-8, 1990.
- Wolmark N, Rockette H, Fisher B, et al.: The benefit of leucovorin-modulated fluorouracil as postoperative adjuvant therapy for primary colon cancer: results from National Surgical Adjuvant Breast and Bowel Project protocol C-03. J Clin Oncol 11 (10): 1879-87, 1993.
- Efficacy of adjuvant fluorouracil and folinic acid in colon cancer. International Multicentre Pooled Analysis of Colon Cancer Trials (IMPACT) investigators. Lancet 345 (8955): 939-44, 1995.
- O'Connell M, Mailliard J, Macdonald J, et al.: An intergroup trial of intensive course 5FU and low dose leucovorin as surgical adjuvant therapy for high risk colon cancer. [Abstract] Proceedings of the American Society of Clinical Oncology 12: A-552, 190, 1993.
- Haller DG, Catalano PJ, Macdonald JS, et al.: Phase III study of fluorouracil, leucovorin, and levamisole in high-risk stage II and III colon cancer: final report of Intergroup 0089. J Clin Oncol 23 (34): 8671-8, 2005.
- Wolmark N, Bryant J, Smith R, et al.: Adjuvant 5-fluorouracil and leucovorin with or without interferon alfa-2a in colon carcinoma: National Surgical Adjuvant Breast and Bowel Project protocol C-05. J Natl Cancer Inst 90 (23): 1810-6, 1998.
- Wolmark N, Rockette H, Mamounas E, et al.: Clinical trial to assess the relative efficacy of fluorouracil and leucovorin, fluorouracil and levamisole, and fluorouracil, leucovorin, and levamisole in patients with Dukes' B and C carcinoma of the colon: results from National Surgical Adjuvant Breast and Bowel Project C-04. J Clin Oncol 17 (11): 3553-9, 1999.
- Okuno SH, Woodhouse CL, Loprinzi CL, et al.: Phase III placebo-controlled clinical trial evaluation of glutamine for decreasing mucositis in patients receiving 5FU (fluorouracil)-base chemotherapy. [Abstract] Proceedings of the American Society of Clinical Oncology 17: A-256, 1998.
- Andre T, Colin P, Louvet C, et al.: Semimonthly versus monthly regimen of fluorouracil and leucovorin administered for 24 or 36 weeks as adjuvant therapy in stage II and III colon cancer: results of a randomized trial. J Clin Oncol 21 (15): 2896-903, 2003.
- Comparison of flourouracil with additional levamisole, higher-dose folinic acid, or both, as adjuvant chemotherapy for colorectal cancer: a randomised trial. QUASAR Collaborative Group. Lancet 355 (9215): 1588-96, 2000.
- Sargent DJ, Goldberg RM, Jacobson SD, et al.: A pooled analysis of adjuvant chemotherapy for resected colon cancer in elderly patients. N Engl J Med 345 (15): 1091-7, 2001.
- Van Cutsem E, Twelves C, Cassidy J, et al.: Oral capecitabine compared with intravenous fluorouracil plus leucovorin in patients with metastatic colorectal cancer: results of a large phase III study. J Clin Oncol 19 (21): 4097-106, 2001.
- Hoff PM, Ansari R, Batist G, et al.: Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer: results of a randomized phase III study. J Clin Oncol 19 (8): 2282-92, 2001.
- Twelves C, Wong A, Nowacki MP, et al.: Capecitabine as adjuvant treatment for stage III colon cancer. N Engl J Med 352 (26): 2696-704, 2005.
- André T, Boni C, Mounedji-Boudiaf L, et al.: Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. N Engl J Med 350 (23): 2343-51, 2004.
- André T, Boni C, Navarro M, et al.: Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial. J Clin Oncol 27 (19): 3109-16, 2009.
- Yothers G, O'Connell MJ, Allegra CJ, et al.: Oxaliplatin as adjuvant therapy for colon cancer: updated results of NSABP C-07 trial, including survival and subset analyses. J Clin Oncol 29 (28): 3768-74, 2011.
- Schmoll HJ, Tabernero J, Maroun J, et al.: Capecitabine Plus Oxaliplatin Compared With Fluorouracil/Folinic Acid As Adjuvant Therapy for Stage III Colon Cancer: Final Results of the NO16968 Randomized Controlled Phase III Trial. J Clin Oncol 33 (32): 3733-40, 2015.
- Grothey A, Sobrero AF, Shields AF, et al.: Duration of Adjuvant Chemotherapy for Stage III Colon Cancer. N Engl J Med 378 (13): 1177-1188, 2018.
- Rougier P, Nordlinger B: Large scale trial for adjuvant treatment in high risk resected colorectal cancers. Rationale to test the combination of loco-regional and systemic chemotherapy and to compare l-leucovorin + 5-FU to levamisole + 5-FU. Ann Oncol 4 (Suppl 2): 21-8, 1993.
Tratamiento del cáncer de colon en estadio IV y recidivante
En el cáncer de colon en estadio IV hay enfermedad metastásica. El tratamiento del cáncer de colon recidivante depende de los sitios de enfermedad recidivante que se verifiquen durante el examen físico o en los estudios radiográficos. Además de los procedimientos radiográficos estándares, la radioinmunocentellografía aporta información clínica que quizás afecte las decisiones sobre el tratamiento. Dichos abordajes no han demostrado mejoras en las medidas de resultados a largo plazo como la supervivencia.
Opciones de tratamiento del cáncer de colon en estadio IV y recidivante
Las opciones de tratamiento del cáncer de colon en estadio IV son las siguientes:
- Resección quirúrgica del cáncer con recidiva local.
- Resección quirúrgica y anastomosis o derivación de una lesión primaria obstructiva o hemorrágica para determinados casos metastásicos.
- Resección de metástasis hepáticas para determinados pacientes que tienen metástasis (la tasa de curación a 5 años para la resección de metástasis solitarias o combinadas excede del 20 %) o ablación en determinados pacientes.
- Resección de metástasis aisladas pulmonares u ováricas en determinados pacientes.
- Radioterapia paliativa.
- Quimioterapia paliativa.
- Terapia dirigida.
- Participación en ensayos clínicos en los que se evalúan nuevos fármacos y terapias biológicas.
- Participación en ensayos clínicos en los que se comparan varios regímenes quimioterapéuticos o terapias biológicas, solos o en combinación.
Tratamiento de las metástasis hepáticas
Se diagnosticarán metástasis hepáticas en cerca del 50 % de los pacientes de cáncer de colon, ya sea en el momento del cuadro clínico inicial o como resultado de la recidiva de la enfermedad. Si bien solo una proporción pequeña de pacientes con metástasis hepáticas son aptos para someterse a una resección quirúrgica, los avances en las técnicas de ablación tumoral y en la administración de quimioterapia regional y sistémica ofrecen varias opciones de tratamiento. Estas incluyen las siguientes:
- Cirugía.
- Quimioterapia neoadyuvante.
- Ablación local.
- Quimioterapia adyuvante.
- Quimioterapia intraarterial.
Cirugía
Las metástasis hepáticas se pueden considerar resecables de acuerdo con los siguientes aspectos:
- Número limitado de lesiones.
- Localización intrahepática de las lesiones.
- Ausencia de compromiso vascular importante.
- Enfermedad extrahepática ausente o limitada.
- Reserva funcional hepática suficiente.
En la mayoría de los estudios no aleatorizados como el ensayo North Central Cancer Treatment Group (NCCTG-934653 [NCT00002575]) una resección en la que se obtienen márgenes sin compromiso tumoral se relacionó con tasas de supervivencia a 5 años del 25 % al 40 % para los pacientes con una metástasis hepática considerada resecable.[Nivel de evidencia C3] El perfeccionamiento de las técnicas quirúrgicas y los avances en las pruebas con imágenes preoperatorias han permitido mejorar la selección de pacientes para la resección. Además, en múltiples estudios de quimioterapia multifarmacológica se demostró que la administración de quimioterapia puede transformar una metástasis, que de forma tradicional, se consideraría irresecable en una metástasis resecable en pacientes que tienen una enfermedad metastásica aislada en el hígado.
Quimioterapia neoadyuvante para metástasis hepáticas irresecables
Los pacientes con metástasis hepáticas que se consideran irresecables a veces son aptos para resección si responden bien a la quimioterapia. Estos pacientes tienen tasas de supervivencia a 5 años similares a las de los pacientes con enfermedad resecable desde el principio. No hay consenso sobre el mejor régimen para convertir las metástasis hepáticas aisladas irresecables en metástasis hepáticas resecables.
Ablación local
La ablación por radiofrecuencia ha surgido como una técnica inocua (morbilidad grave del 2 % y tasa de mortalidad de <1 %) que a veces proporciona control tumoral a largo plazo. La ablación por radiofrecuencia y la ablación crioquirúrgica aún son opciones para los pacientes con tumores irresecables y para quienes no son aptos para una resección hepática.
Otras técnicas de ablación local que se han usado para tratar las metástasis hepáticas son la embolización y la radioterapia intersticial. Es posible sopesar el uso de una resección quirúrgica para los pacientes con metástasis pulmonares limitadas y los pacientes con metástasis pulmonares y hepáticas simultáneas; en pacientes muy seleccionados, se logra una supervivencia a 5 años.
Quimioterapia adyuvante o neoadyuvante para metástasis hepáticas resecables
La función de la quimioterapia adyuvante después de una resección con potencial curativo de metástasis hepáticas es incierta.
Datos probatorios (quimioterapia adyuvante o neoadyuvante para metástasis hepáticas resecables):
En la época anterior al uso de FOLFOX (leucovorina cálcica [LV], fluorouracilo [5-FU] y oxaliplatino) y FOLFIRI (5-FU, LV e irinotecán), en dos ensayos se intentó asignar al azar a los pacientes para recibir 5-FU/LV o someterse a observación después de la resección; sin embargo, ambos estudios se cerraron antes de tiempo por poca inclusión de pacientes.
- En el ensayo FFCD-9902 [NCT00304135] se asignó al azar a 173 pacientes (se planificó que fueran 200 pacientes) para recibir 5-FU y LV posoperatorio, que es el régimen de la Mayo Clinic, o someterse a observación.
- La tasa de supervivencia sin enfermedad (SSE) a 5 años fue del 33,5 % para los pacientes del grupo de quimioterapia y de 26,7 % para los pacientes del grupo de control (análisis multivariante de Cox: oportunidad relativa [OR] de recidiva o muerte, 0,66; intervalo de confianza [IC] 95 %, 0,46–0,96; P = 0,028). La tasa de supervivencia general (SG) a 5 años no fue significativamente diferente entre los grupos (grupo de quimioterapia, 51,1 % vs. grupo de control, 41,1 %; ORde muerte, 0,73; IC 95 %, 0,48-1,10; P = 0,13).
- En el ensayo internacional de European Organisation for Research and Treatment of Cancer, el National Cancer Institute of Canada y el Gruppo Interdisciplinare Valutazione Interventi in Oncologia (EORTC/NCIC/GIVIO), se intentó una asignación al azar similar para pacientes sometidos a una resección quirúrgica de metástasis hepáticas. El estudio cerró por poca inclusión de pacientes y en su lugar se realizó un análisis combinado de este estudio con el estudio FFCD-9902. En el análisis combinado, se incluyó a 278 pacientes (138 sometidos a quimioterapia y 14 sometidos a cirugía sola).
- La mediana de supervivencia sin progresión (SSP) fue de 27,9 meses en el grupo de quimioterapia y de 18,8 meses en el grupo de cirugía sola (cociente de riesgos instantáneos [CRI], 1,32; IC 95 %, 1,00–1,76; P = 0,058).
- La mediana de SG fue de 62,2 meses en el grupo de quimioterapia comparada con 47,3 meses en el grupo de cirugía sola (CRI, 1,32; IC 95 %, 0,95–1,82; P = 0,095).
En la era de la quimioterapia multifarmacológica, en dos estudios posteriores se evaluó la función de este tipo de quimioterapia en el entorno adyuvante después de la resección de metástasis hepáticas de cáncer colorrectal.
- En un estudio de fase III, se asignó al azar a 306 pacientes a recibir 5-FU y LV o FOLFIRI después de la resección de metástasis hepáticas.
- No hubo diferencia en la SSE (21,6 meses para 5-FU y LV vs. 24,7 meses con FOLFIRI; CRI, 0,89; P del orden logarítmico = 0,44) ni en la SG (CRI, 1,09; IC 95 %, 0,72–1,64).
- En el ensayo EORTC (EORTC-40983 NCT00006479) se asignó al azar a 364 pacientes que tenían hasta 4 metástasis hepáticas resecables para recibir FOLFOX perioperatorio (6 ciclos prequirúrgicos y 6 ciclos posquirúrgicos) o someterse a cirugía sola.
- La tasa de SSP fue del 28,1 % (IC 95,66 %, 21,3–35,5 %) para el grupo de cirugía sola y del 35,4 % (28,1–42,7 %; CRI 0,79; 0,62–1,02; P = 0,058) para el grupo de quimioterapia perioperatoria. No hubo diferencia en la SG. En un análisis posterior se observó que la diferencia en la SSP para los pacientes realmente aptos aumentó del 8,1 % (de 28,1 % [21,2–36,6 %] al 36,2 % [28,7–43,8 %]; CRI, 0,77 [0,60–1,00]; P = 0,041). En los pacientes que se sometieron a resección de las metástasis hepáticas, la diferencia en la SSP aumentó del 9,2 % (de 33,2 % [25,3–41,2 %] a 42,4 % [34,0–50,5 %]; CRI, 0,73 [0,55–0,97]; P = 0,025).
- Las complicaciones posoperatorias reversibles se presentaron con más frecuencia después de la quimioterapia que la cirugía (40 [25 %] de 159 complicaciones vs. 27 [16 %] de 170 complicaciones; P = 0,04). Después de la cirugía, se presentaron dos muertes en el grupo de cirugía sola y una en el grupo de quimioterapia perioperatoria.
No hay evidencia científica de nivel alto que permita demostrar que la quimioterapia perioperatoria o posoperatoria mejoren la SG de pacientes sometidos a resección de metástasis hepáticas. De todos modos, a partir del análisis posterior de subconjuntos del estudio EORTC, algunos médicos consideran que el tratamiento perioperatorio o posoperatorio es razonable en este entorno.
Quimioterapia intraarterial después de resección hepática
La quimioterapia intraarterial hepática con floxuridina para las metástasis hepáticas produce tasas de respuestas generales más altas, pero no mejoras uniformes para la supervivencia en comparación con la quimioterapia sistémica. En un metanálisis de estudios aleatorizados llevados a cabo en la era cuando solo estaban disponibles las fluoropirimidinas para la terapia sistémica, no se observaron ventajas de supervivencia.
Datos probatorios (quimioterapia intraarterial después de resección hepática):
En dos ensayos se evaluó el uso de la floxuridina arterial hepática en el entorno adyuvante después de la resección hepática.
- En un ensayo en el que se comparó la floxuridina arterial hepática y la dexametasona con 5-FU y LV solas, se encontró mejora de las tasas de SSP a 2 años (57 vs. 42 %; P = 0,07) y las tasas de SG (86 vs. 72 %; P = 0,03) en los pacientes del grupo de terapia combinada, pero no se observó una diferencia estadísticamente significativa en la mediana de supervivencia en comparación con el tratamiento con 5-FU sistémico solo.[Nivel de evidencia A1]
- La mediana de supervivencia para el grupo de terapia combinada fue de 72,2 versus 59,3 meses para el grupo de monoterapia (P = 0,21).
- En un segundo ensayo preoperatorio se asignó al azar a 109 pacientes con 1 a 3 metástasis hepáticas colorrectales con posibilidad de ser resecadas a no recibir tratamiento adicional o a recibir floxuridina arterial hepática posoperatoria y 5-FU sistémico. De los pacientes asignados al azar, el 27 % no se consideraron aptos en el momento de la cirugía, lo que dejó solo a 75 pacientes evaluables en cuanto a recidiva y supervivencia.
- Si bien disminuyó la recidiva hepática del cáncer, la mediana de supervivencia a 4 años no fue significativamente diferente entre los grupos de pacientes.
Se necesitan más estudios para evaluar este abordaje de tratamiento y determinar si una quimioterapia sistémica combinada más eficaz por sí sola proporcionaría resultados similares a la terapia intraarterial hepática combinada con tratamiento sistémico.
En varios estudios se observó un aumento de los efectos tóxicos locales debido a la terapia de infusión hepática, entre ellas, las anomalías en la función hepática y la esclerosis biliar mortal.
Tratamiento del cáncer de colon en estadio IV y recidivante
- Cirugía.
- Terapia sistémica.
- Inmunoterapia.
Cirugía
El tratamiento de los pacientes con cáncer de colon recidivante o avanzado depende de la ubicación de la enfermedad. Para los pacientes con enfermedad recidivante local, metastásica solo en el hígado o metastásica solo en el pulmón, la resección quirúrgica, si es posible, es el único tratamiento con potencial curativo.
Terapia sistémica
Los siguientes son fármacos aprobados por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) para pacientes de cáncer colorrectal metastásico, que se usan solos o combinados con otros fármacos:
- 5-fluorouracilo.
- Capecitabina.
- Irinotecán.
- Oxaliplatino.
- Bevacizumab.
- FOLFOXIRI (irinotecán, oxaliplatino, LV y 5-FU).
- Cetuximab.
- Aflibercept.
- Ramucirumab.
- Panitumumab.
- Anticuerpo contra el receptor del factor de crecimiento epidérmico (EGFR) versus un anticuerpo contra el factor de crecimiento endotelial vascular (VEGF) con quimioterapia de primera línea.
- Regorafenib.
- TAS-102.
5-fluorouracilo
Cuando el 5-FU era el único fármaco de quimioterapia activo, en los ensayos de pacientes con enfermedad local avanzada, irresecable o metastásica se encontraron respuestas parciales, prolongación del tiempo transcurrido hasta la progresión de la enfermedad (TTP) y mejora de la supervivencia y calidad de vida para los pacientes que recibieron quimioterapia versus el mejor cuidado médico de apoyo. En varios ensayos se analizaron la actividad y los efectos tóxicos de diversos regímenes de 5-FU y LV con diferentes dosis y esquemas de administración; en esencia, se observaron resultados equivalentes con una mediana de supervivencia de cerca de 12 meses.
Capecitabina
Antes del advenimiento de la quimioterapia multifarmacológica, en dos estudios aleatorizados se demostró que la capecitabina se vinculó con una eficacia equivalente en comparación a la del régimen de la Mayo Clinic de 5-FU y LV.[Nivel de evidencia A1]
Irinotecán
En tres estudios aleatorizados se describieron mejores tasas de respuesta, SSP y SG cuando se combinaron irinotecán u oxaliplatino con 5-FU y LV.
Datos probatorios (irinotecán):
- En un estudio intergrupal (NCCTG-N9741 [NCT00003594]) se comparó irinotecán, 5-FU y LV (IFL) con oxaliplatino, LV y 5-FU (FOXFOX-4) para el tratamiento de primera línea de pacientes con cáncer colorrectal metastásico.
- Los pacientes que recibieron FOLFOX-4 en comparación con los pacientes que recibieron IFL, mejoraron la SSP (mediana, 6,9 vs. 8,7 meses; P = 0,014; CRI, 0,74; IC 95 %, 0,61–0,89) y la SG (15,0 vs. 19,5 meses, P = 0,001; CRI, 0,66; IC 95 %, 0,54–0,82).
- Con posterioridad, en dos estudios se compararon los regímenes FOLFOX y FOLFIRI, y se permitió que los pacientes cambiaran de grupo después de la progresión de la enfermedad durante la terapia de primera línea.[Nivel de evidencia B1]
- La SSP y la SG fueron idénticas entre los grupos de tratamiento en ambos estudios.
- En el ensayo Bolus, Infusional, or Capecitabine with Camptosar-Celecoxib (BICC-C [NCT00094965]), se evaluaron varios regímenes a base de irinotecán para pacientes de cáncer colorrectal metastásico sin tratamiento previo, entre ellos: FOLFIRI, irinotecán con bolo de 5-FU combinado con LV (mIFL) y capecitabina con irinotecán (CAPIRI).[Nivel de evidencia A1]
- En el estudio se asignó al azar a 430 pacientes, pero se suspendió antes de lo previsto debido a escasa inscripción.
- Los pacientes que recibieron FOLFIRI tuvieron una mejor SSP que los pacientes que recibieron mIFL (7,6 vs. 5,9 meses; P = 0,004) o CAPIRI (7,6 vs. 5,8 meses; P = 0,015).
- Los pacientes que recibieron CAPIRI presentaron las tasas más altas, de grado 3 o mayor, de náuseas, vómitos, diarrea, deshidratación y eritrodisestesia palmoplantar.
A partir de la publicación de estos estudios, el uso de FOLFOX o FOLFIRI se considera aceptable para el tratamiento de primera línea de pacientes con cáncer colorrectal metastásico.
Sin embargo, se prefiere usar FOLFIRI cuando se emplea un régimen a base de irinotecán como tratamiento de primera línea del cáncer colorrectal metastásico.[Nivel de evidencia B1]
Oxaliplatino
En ensayos aleatorizados de fase III se abordó la equivalencia de usar capecitabina en lugar de una infusión de 5-FU. En dos estudios de fase III se evaluó el uso de 5-FU y oxaliplatino (FUOX) versus capecitabina y oxaliplatino (CAPOX).
Datos probatorios (oxaliplatino):
- El AIO Colorectal Study Group asignó al azar a 474 pacientes para recibir 5-FU y LV con oxaliplatino (FUFOX) o CAPOX.
- La mediana de SSP fue de 7,1 meses para el grupo de CAPOX y de 8,0 meses para el grupo de FUFOX (CRI = 1,17; IC 95 %, 0,96–1,43; P = 0,117); el CRI se ubicó dentro del intervalo de equivalencia predeterminado.
- El Grupo de Tratamiento de los Tumores Digestivos asignó al azar a 348 pacientes a recibir CAPOX o FUOX.[Nivel de evidencia B1]
- El TTP fue de 8,9 versus 9,5 meses (P = 0,153) y se ubicó dentro del intervalo de ausencia de inferioridad predeterminado.
Cuando se utiliza un régimen a base de oxaliplatino como tratamiento de primera línea para el cáncer colorrectal metastásico, el régimen de CAPOX no es inferior al régimen de FUOX.
Antes de disponerse de cetuximab, panitumumab, bevacizumab y aflibercept para la terapia de segunda línea, la quimioterapia de segunda línea con irinotecán en pacientes tratados con 5-FU y LV como terapia de primera línea demostró una mejora de la SG en comparación con una infusión de 5-FU o el uso de cuidados médicos de apoyo.
Del mismo modo, en un ensayo de fase III se asignó al azar a pacientes cuya enfermedad progresó con el irinotecán combinado con 5-FU y LV para recibir un bolo y una infusión de 5-FU y LV (LV5FU2), oxaliplatino en monoterapia o FOLFOX-4. La mediana del TTP para FOLFOX-4 versus LV5FU2 fue de 4,6 versus 2,7 meses (prueba del orden logarítmico estratificada P bilateral < 0,001).[Nivel de evidencia B1]
Bevacizumab
El bevacizumab es un anticuerpo monoclonal parcialmente humanizado que se une al VEGF. Es aceptable añadir bevacizumab a FOLFIRI o FOLFOX para pacientes que reciben tratamiento de primera línea de cáncer colorrectal metastásico.
Datos probatorios (bevacizumab):
- Después de la aprobación del bevacizumab, se enmendó el ensayo BICC-C y se asignó al azar a otros 117 pacientes para recibir FOLFIRI con bevacizumab o mIFL con bevacizumab.
- Aunque no se encontró diferencia estadísticamente significativa para el criterio principal de valoración de la SSP, los pacientes que recibieron FOLFIRI con bevacizumab presentaron una mejora significativa de la SG (que todavía no se había alcanzado al cabo de una mediana de seguimiento de 22,6 vs. 19,2 meses, P = 0,007).
- Se asignó al azar a pacientes de cáncer colorrectal metastásico no tratados para recibir IFL o IFL con bevacizumab.[Nivel de evidencia A1]
- Los pacientes asignados al azar a IFL con bevacizumab tuvieron una mejora significativa de la SSP (10,6 meses para el grupo de IFL y bevacizumab en comparación con 6,2 meses en el grupo de IFL y placebo; CRIde progresión de la enfermedad, 0,54; P< 0,001) y SG (20,3 meses en el grupo de IFL y bevacizumab en comparación con 15,6 meses en el grupo de IFL y placebo; CRIde muerte 0,66, P = 0,001).
- A pesar de la ausencia de datos directos, en la práctica habitual se añadió bevacizumab a FOLFOX como régimen estándar de primera línea a partir de los resultados del ensayo NCCTG-N9741. Después, en un estudio aleatorizado de fase III, con diseño factorial de 2 × 2, se asignó al azar a pacientes de cáncer colorrectal no tratado en estadio IV a recibir CAPOX versus FOLFOX4 y, luego, bevacizumab versus placebo. La SSP fue el criterio principal de valoración.
- En este ensayo se asignó al azar a 1401 pacientes y la mediana de SSP fue de 9,4 meses para los pacientes que recibieron bevacizumab y 8,0 meses para los pacientes que recibieron placebo (CRI, 0,83; IC 97,5 %, 0,72–0,95; P = 0,0023).[Nivel de evidencia B1]
- La mediana de SG fue de 21,3 meses para los pacientes que recibieron bevacizumab y 19,9 meses para los pacientes que recibieron placebo (CRI, 0,89; IC 97,5 %, 0,76–1,03; P = 0,077).
- La mediana de SSP (análisis por intención de tratar) fue de 8,0 meses en el análisis combinado de todos los grupos que recibieron CAPOX versus 8,5 meses para todos los grupos que recibieron FOLFOX-4 (CRI, 1,04; IC 97,5 %, 0,93–1,16); el límite superior del IC 97,5 % notificado se ubicó por debajo del margen predefinido de ausencia de inferioridad de 1,23.
- Es probable que el efecto del bevacizumab en la SG sea menor del que se observó en el estudio original de Hurwitz.
- Los investigadores del Eastern Cooperative Oncology Group asignaron al azar a pacientes cuya enfermedad progresó con el uso de 5-FU, leucovorina e irinotecán, para recibir FOLFOX o FOLFOX con bevacizumab.
- Los pacientes asignados al azar a FOLFOX con bevacizumab presentaron una mejoría estadísticamente significativa de la SSP (7,43 vs. 4,7 meses, CRI, 0,61; P< 0,0001) y la SG (12,9 vs. 10,8 meses; CRI, 0,75; P = 0,0011).[Nivel de evidencia A1]
A partir de estos estudios se considera aceptable añadir bevacizumab a FOLFIRI o FOLFOX para pacientes que reciben tratamiento de primera línea de cáncer colorrectal metastásico. Una duda importante fue si el uso de bevacizumab se justificaba luego de una terapia de primera línea con un componente de bevacizumab. En el 2012 American Society of Clinical Oncology Annual Meeting, se presentaron datos de un ensayo aleatorizado controlado. En el ensayo, 820 pacientes de cáncer colorrectal metastásico con progresión de la enfermedad durante la quimioterapia de primera línea con bevacizumab se asignaron al azar para recibir quimioterapia sin bevacizumab o quimioterapia con bevacizumab. Los pacientes que recibieron bevacizumab presentaron mejoría de la SG en comparación con los pacientes que no recibieron bevacizumab. La mediana de SG fue de 11,2 meses para los pacientes que recibieron quimioterapia con bevacizumab y de 9,8 meses para los pacientes que recibieron quimioterapia sin bevacizumab (CRI, 0,81; IC 95 %, 0,69–0,94; prueba del orden logarítmico no estratificada, P = 0,0062). La mediana de SSP fue de 5,7 meses en los pacientes que recibieron quimioterapia con bevacizumab y de 4,1 meses para aquellos que recibieron quimioterapia sin bevacizumab (CRI, 0,68; IC 95 %, 0,59–0,78; prueba del orden logarítmico no estratificada P< 0,0001).[Nivel de evidencia A1]
FOLFOXIRI
Datos probatorios (FOLFOXIRI):
- En un estudio aleatorizado de fase III con 508 pacientes de cáncer colorrectal metastásico sin tratamiento previo, se comparó la combinación de FOLFOXIRI y bevacizumab con la combinación de FOLFIRI y bevacizumab.[Nivel de evidencia B1]
- La mediana de SSP fue de 12,1 meses en el grupo de FOLFOXIRI en comparación con 9,7 meses en el grupo de FOLFIRI (CRIde progresión, 0,75; IC 95 %, 0,62–0,90; P = 0,003). La SG no fue significativamente diferente entre los grupos (31,0 vs. 25,8 meses; CRIde muerte, 0,79; IC 95 %, 0,63-1,00; P = 0,054).
- Los pacientes que recibieron FOLFOXIRI tuvieron significativamente más efectos tóxicos de grados 3 y 4, como neutropenia, estomatitis y neuropatía periférica.
Cetuximab
El cetuximab es un anticuerpo monoclonal parcialmente humanizado contra el EGFR. Debido a que el cetuximab afecta la señalización de tirosina–cinasas en la superficie de la membrana celular, los tumores con mutaciones que causan activación de las vías descendientes del EGFR como las mutaciones en KRAS, no son sensibles a sus efectos. Añadir el cetuximab a una quimioterapia multifarmacológica mejora la supervivencia en los pacientes con cáncer de colon que carecen de una mutación en KRAS (es decir, KRAS natural). Cabe resaltar que los pacientes cuyos tumores expresan una mutación en KRAS quizás tengan desenlaces más precarios cuando el cetuximab se agrega a regímenes de quimioterapia multifarmacológica que contienen bevacizumab.
Datos probatorios (cetuximab):
- Se llevó a cabo un estudio aleatorizado de fase II sobre el uso de cetuximab solo o irinotecán combinado con cetuximab, para los pacientes cuya enfermedad progresó con regímenes que contenían irinotecán.[Nivel de evidencia C3]
- La mediana de TTP en los pacientes que recibieron cetuximab fue de 1,5 meses comparada con una mediana de TTP de 4,2 meses en los pacientes que recibieron irinotecán y cetuximab.[Nivel de evidencia B1]
- A partir de este estudio, se aprobó el cetuximab para usarlo en pacientes de cáncer colorrectal metastásico resistente al 5-FU y al irinotecán.
- En el Crystal Study (EMR 62202-013 [NCT00154102]) se asignó al azar a 1198 pacientes de cáncer colorrectal en estadio IV para recibir FOLFIRI, con cetuximab o sin este.[Nivel de evidencia B1]
- La adición de cetuximab se relacionó con una mejora de la SSP (CRI, 0,85; IC 95 %, 0,72–0,99; P = 0,048 mediante prueba estratificada del orden logarítmico), pero no de la SG.
- En estudios retrospectivos de pacientes de cáncer colorrectal metastásico, se indicó que las respuestas a la terapia con anticuerpos contra el EGFR se limitan a pacientes con tumores que albergan tipos naturales de KRAS (es decir, carecen de mutaciones activadoras en los codones 12 o 13 del gen KRAS).
- Se realizó un análisis de un subgrupo para evaluar la eficacia con respecto al estado del gen KRAS en pacientes inscritos en el Crystal Study. Hubo una interacción significativa entre el estado de la mutación en KRAS y la respuesta tumoral al tratamiento (P = 0,03) pero no para la SSP (P = 0,07). Entre los pacientes de tumores con KRAS natural, el CRI favoreció al grupo de FOLFIRI y cetuximab (CRI, 0,68; IC 95 %, 0,50–0,94).
- En un estudio aleatorizado, los pacientes de cáncer colorrectal metastásico recibieron capecitabina, oxaliplatino y bevacizumab con cetuximab o sin este.[Nivel de evidencia B1]
- La mediana de SSP fue de 9,4 meses para el grupo que recibió cetuximab y de 10,7 meses para el grupo que no recibió cetuximab (P = 0,01).
- En un análisis de subconjuntos, los pacientes tratados con cetuximab cuyos tumores albergaban una mutación en el gen KRAS presentaron una disminución significativa de la SSP en comparación con los pacientes cuyos tumores tenían KRAS natural (8,1 vs. 10,5 meses; P = 0,04).
- Los pacientes que tenían tumores con mutación en KRAS y recibieron cetuximab presentaron una SSP (8,1 vs. 12,5 meses; P = 0,003) y una SG (17,2 vs. 24,9 meses; P = 0,03) significativamente más cortas versus los pacientes con mutación en KRAS que no recibieron cetuximab.
- En el ensayo del Medical Research Council (MRC) (COIN [NCT00182715]) se buscó dilucidar si era beneficioso agregar cetuximab a la quimioterapia combinada de una fluoropirimidina y oxaliplatino para el tratamiento de primera línea de pacientes cuyos tumores expresan KRAS natural.
- Además, el MRC trató de evaluar el efecto de la quimioterapia intermitente en comparación con la quimioterapia continua. Los 1630 pacientes se asignaron al azar a los siguientes tres grupos de tratamiento:
- Grupo A: fluoropirimidina y oxaliplatino.
- Grupo B: fluoropirimidina, oxaliplatino y cetuximab.
- Grupo C: fluoropirimidina y oxaliplatino intermitentes.
- Las comparaciones entre los grupos A y B, y los grupos A y C se analizaron y publicaron por separado.
- En los pacientes cuyos tumores expresaban KRAS natural (grupo A, n = 367; grupo B, n = 362), no hubo diferencias de la SG entre los grupos de tratamiento (mediana de supervivencia, 17,9 meses [intervalo intercuartílico (IIC), 10,3–29,2] en el grupo de control vs. 17,0 meses [IIC, 9,4–30,1] en el grupo de cetuximab; CRI, 1,04; IC 95 %, 0,87–1,23; P = 0,67). Tampoco hubo efecto en la SSP (8,6 meses [IIC, 5,0–12,5] en el grupo de control vs. 8,6 meses [IIC, 5,1–13,8] en el grupo de cetuximab; CRI, 0,96; IC 95 %; 0,82–1,12; P = 0,60).[Nivel de evidencia A1]
- Las razones de la ausencia de beneficio de la adición de cetuximab no son claras. En los análisis de subgrupos se indica que la capecitabina se relacionó con un desenlace inferior y que los pacientes tratados con cetuximab reciben terapia de segunda línea con menor frecuencia.
- No hubo diferencia entre los pacientes que recibieron tratamiento continuo (grupo A) e intermitente (grupo C). La mediana de supervivencia en la población de intención de tratar (n = 815 en ambos grupos) fue de 15,8 meses (IIC, 9,4–26,1) en el grupo A y 14,4 meses (IIC, 8,0–24,7) en el grupo C (CRI, 1,084; IC 80 %, 1,008–1,165). En la población por protocolo, que incluyó solo a los pacientes sin progresión a las 12 semanas que fueron asignados al azar a continuar el tratamiento o suspender por un tiempo la quimioterapia (grupo A, n = 467; grupo C, n = 511), la mediana de supervivencia fue de 19,6 meses (IIC, 13,0–28,1) en el grupo A y de 18,0 meses (IIC, 12,1–29,3) en el grupo C (CRI, 1,087; IC 95 %, 0,986–1,198). Los límites superiores para los IC de los CRI en ambos análisis fueron superiores al límite predefinido de ausencia de inferioridad. Si bien no se logró determinar la ausencia de inferioridad para la quimioterapia intermitente, se encontraron diferencias clínicas insignificantes en los desenlaces de los pacientes.
- Además, el MRC trató de evaluar el efecto de la quimioterapia intermitente en comparación con la quimioterapia continua. Los 1630 pacientes se asignaron al azar a los siguientes tres grupos de tratamiento:
- En el estudio OPUS se buscó evaluar el efecto de añadir cetuximab al tratamiento de primera línea con el régimen FOLFOX, en un estudio sin anonimato, aleatorizado, multicéntrico de fase II con pacientes de cáncer colorrectal metastásico que expresa EGFR.
- En el ensayo, 344 pacientes se asignaron al azar para recibir FOLFOX-4 solo o FOLFOX-4 y cetuximab. No hubo diferencia estadísticamente significativa para la tasa de respuesta o la SSP.
- En un análisis de subgrupos, se analizó de manera separada a los pacientes que tenían tumores con KRAS natural. En la población con tumores que tenían KRAS natural, hubo mejora estadísticamente significativa en la tasa de respuesta (61 vs. 37 %; P = 0,011) y en la SSP (7,7 vs. 7,2 meses; P = 0,0163).
- En un análisis de subgrupos, los pacientes con tumores que tenían una mutación en KRAS y que recibieron FOLFOX-4 con cetuximab presentaron una SSP significativamente más precaria que los pacientes con tumores que tenían una mutación en KRAS y que recibieron FOLFOX-4 (5,5 vs. 8,6 meses; P = 0,0192).[Nivel de evidencia B1]
Aflibercept
El aflibercept es una molécula anti-VEGF nueva que se evalúa como componente de la terapia de segunda línea para pacientes de cáncer colorrectal metastásico.
Datos probatorios (aflibercept):
- En un ensayo, se asignó al azar a 1226 pacientes para recibir aflibercept (4 mg/kg IV) o placebo cada 2 semanas en combinación con FOLFIRI.[Nivel de evidencia A2]
- Los pacientes que recibieron aflibercept y FOLFIRI presentaron una mejoría significativa de las tasas de SG, con medianas de supervivencia de 13,50 meses en comparación con los pacientes que recibieron placebo y FOLFIRI, quienes presentaron una mediana de supervivencia de 12,06 meses (CRI, 0,817; IC 95,34 %, 0,713–0,937; P = 0,0032).
- Los pacientes que recibieron aflibercept y FOLFIRI también mejoraron significativamente las tasas de SSP, y la mediana de SSP fue de 6,90 meses en comparación con los pacientes que recibieron placebo y FOLFIRI, quienes presentaron una mediana de SSP de 4,67 meses (CRI, 0,758; IC 95 %, 0,661–0,869; P< 0,0001).
- A partir de estos resultados, se considera que aflibercept y FOLFIRI es un régimen de segunda línea aceptable para pacientes tratados previamente con quimioterapia a base de FOLFOX. Hasta el momento no se ha evaluado en ningún ensayo clínico si se debe continuar bevacizumab o iniciar aflibercept para la terapia de segunda línea, y no hay datos disponibles.
Ramucirumab
El ramucirumab es un anticuerpo monoclonal humanizado por completo que se une al receptor 2 del factor de crecimiento endotelial vascular.
Datos probatorios (ramucirumab):
- En un estudio aleatorizado sin enmascaramiento de fase III RAISE (NCT01183780), se aleatorizó a 1072 pacientes con cáncer colorrectal en estadio IV que progresó durante la quimioterapia de primera línea para recibir FOLFIRI con ramucirumab (8 mg/kg) o sin este.[Nivel de evidencia A1]
- Los pacientes asignados a FOLFIRI con ramucirumab presentaron una mejoría significativa de la mediana de SG (13,3 vs. 11,7 meses; CRI, 0,84; P = 0,0219) y SSP (5,7 vs. 4,5 meses; CRI, 0,793; P = 0,0005).
- Los efectos adversos de grado 3 fueron más comunes en el grupo de ramucirumab, incluso la neutropenia de grado 3.
- A partir de estos datos se considera que FOLFIRI y ramucirumab es un régimen de segunda línea aceptable en pacientes tratados previamente con FOLFOX y bevacizumab. No se ha evaluado en ningún ensayo clínico si se debe continuar bevacizumab o si se debe usar ramucirumab para la quimioterapia de segunda línea.
Panitumumab
El panitumumab es un anticuerpo totalmente humanizado contra el EGFR. La FDA aprobó el panitumumab para su uso en pacientes de cáncer colorrectal metastásico resistente a la quimioterapia. En ensayos clínicos, se demostró la eficacia de panitumumab como fármaco único o de terapia combinada, lo que fue congruente con los efectos de cetuximab en la SSP y la SG. Parece que hay un efecto de clase homogéneo.
Datos probatorios (panitumumab):
- En un ensayo de fase III, se asignó al azar a pacientes de cáncer colorrectal resistente a la quimioterapia a recibir panitumumab o el mejor cuidado médico de apoyo.[Nivel de evidencia B1]
- Los pacientes que recibieron panitumumab experimentaron una mejora de la SSP (8 vs. 7,3 semanas; CRI, 0,54; IC 95 %, 0,44–0,66; P< 0,0001).
- No hubo diferencia en la SG, se cree que esto se debe a que 76 % de los pacientes del grupo de cuidados médicos de apoyo se pasaron al grupo de panitumumab.
- En el estudio Panitumumab Randomized Trial in Combination With Chemotherapy for Metastatic Colorectal Cancer to Determine Efficacy (PRIME [NCT00364013]), se asignó al azar a 1183 pacientes a FOLFOX-4 con panitumumab o sin este como terapia de primera línea para el cáncer colorrectal metastásico. El estudio se modificó para aumentar el tamaño de la muestra y tratar por separado a los pacientes con tumores que expresaban KRAS natural y a aquellos con tumores que expresaban una mutación en KRAS.[Nivel de evidencia B1]
- En los pacientes cuyos tumores expresaban KRAS natural y que recibieron panitumumab y FOLFOX-4 se observó una mejoría estadísticamente significativa en la SSP en comparación con quienes recibieron FOLFOX-4 solo (CRI, 0,80; IC 95 %, 0,66–0,97; P = 0,02, prueba de orden logarítmico estratificada).
- La mediana de SSP fue de 9,6 meses (IC 95 %, 9,2–11,1) en los pacientes que recibieron panitumumab y FOLFOX-4 y de 8,0 meses (IC 95 %, 7,5–9,3) en los pacientes que recibieron FOLFOX-4. La SG no fue significativamente diferente entre los grupos (CRI, 0,83; IC 95 %, 0,67–1,02; P = 0,072).
- Para los pacientes que tenían tumores con una mutación en KRAS, la SSP fue más precaria cuando se añadió panitumumab (CRI, 1,29; IC 95 %, 1,04–1,62; P = 0,02, prueba del orden logarítmico estratificada).
- La mediana de SSP fue de 7,3 meses (IC 95 %, 6,3–8,0) con panitumumab y FOLFOX-4 y de 8,8 meses (IC 95 %, 7,7–9,4) con FOLFOX-4 solo.
- Con posterioridad, en un análisis retrospectivo se evaluó a los pacientes con un estado de exón 2 en KRAS natural con el fin de identificar otras mutaciones en KRAS y BRAF.[Nivel de evidencia C1]
- De los 620 pacientes identificados al inicio cuyos tumores no expresaban una mutación en el exón 2 de KRAS, se encontró que 108 pacientes (17 %) tenían otras mutaciones en RAS y que 53 pacientes (8 %) tenían mutaciones en BRAF. En un análisis retrospectivo, los pacientes sin mutaciones en RAS o BRAF tuvieron una SSP (10,8 vs. 9,2 meses; P = 0,002) y SG más prolongadas (28,3 vs. 20,9 meses; P = 0,02) cuando se asignaron al grupo que recibió FOLFOX-4 y panitumumab que los pacientes asignados al grupo de FOLFOX-4.
- Igualmente, la adición de panitumumab a un régimen de FOLFOX y bevacizumab resultó en una SSP más precaria y una peor toxicidad en comparación con un régimen de FOLFOX y bevacizumab solo en pacientes con cáncer de colon metastásico no seleccionados según la mutación en KRAS (11,4 vs. 10,0 meses; CRI, 1,27; IC 95 %, 1,06–1,52).[Nivel de evidencia B1]
- En otro estudio (NCT00339183), los pacientes de cáncer colorrectal metastásico que habían recibido un régimen con fluoropirimidina se asignaron al azar a FOLFIRI o FOLFIRI y panitumumab.[Nivel de evidencia B1]
- En un análisis posterior, los pacientes cuyos tumores tenían KRAS natural mostraron una ventaja estadísticamente significativa en la SSP (CRI, 0,73; IC 95 %, 0,59–0,90; P = 0,004, prueba del orden logarítmico estratificada).
- La mediana de SSP fue de 5,9 meses (IC 95 %, 5,5–6,7) para el grupo que recibió panitumumab y FOLFIRI, y de 3,9 meses (IC 95 %, 3,7–5,3) para el grupo que recibió FOLFIRI solo.
- La SG no fue significativamente diferente. Los pacientes con tumores que expresan una mutación en KRAS no se beneficiaron de la adición de panitumumab.
- En un análisis posterior, los pacientes cuyos tumores tenían KRAS natural mostraron una ventaja estadísticamente significativa en la SSP (CRI, 0,73; IC 95 %, 0,59–0,90; P = 0,004, prueba del orden logarítmico estratificada).
Anticuerpo contra el receptor del factor de crecimiento epidérmico versus anticuerpo contra el factor de crecimiento vascular con quimioterapia de primera línea
En la atención de los pacientes con cáncer colorrectal en estadio IV, es incierto si los pacientes de cáncer que expresan KRAS natural deben recibir un anticuerpo anti-EGFR con quimioterapia o un anticuerpo anti-VEGF con quimioterapia. En dos estudios se intentó responder esta duda.
Datos probatorios (anticuerpo anti-EGFR vs. anticuerpo anti-VEGF con quimioterapia de primera línea)
- En el estudio FIRE-3 [NCT00433927], 592 pacientes cuyos tumores expresaban un exón 2 de KRAS natural y no se habían tratado antes se asignaron al azar a recibir FOLFIRI y cetuximab (297 pacientes) o FOLFIRI y bevacizumab (295 pacientes). El criterio principal de valoración del estudio fue la tasa de respuesta objetiva.[Nivel de evidencia A1]
- La tasa de respuesta objetiva no difirió de forma significativa entre los grupos (tasa de respuesta objetiva, 62,0 %; IC 95 %, 56,2–67,5 % vs. tasa de respuesta objetiva, 58,0 %; IC 95 %, 52,1–63,7 %; OR, 1,18; IC 95 %, 0,85–1,64; P = 0,18).
- La mediana de SSP fue de 10,0 meses (IC 95 %, 8,8–10,8) en el grupo de cetuximab y 10,3 meses (IC 95 %, 9,8–11,3) en el grupo de bevacizumab (CRI, 1,06; IC 95 %, 0,88–1,26; P = 0,55).
- La mediana de SG fue de 28,7 meses (IC 95 %, 24,0–36,6) en el grupo de cetuximab comparada con 25,0 meses (22,7–27,6) en el grupo de bevacizumab (CRI, 0,77; IC 95 %, 0,62–0,96; P = 0,017).
- En un análisis posterior de pacientes cuyos tumores se sometieron a un análisis ampliado de la expresión de RAS natural (con secuenciación de puntos de hipermutabilidad dentro de los genes KRAS y NRAS, incluso los codones 12 y 13 del exón 2; los codones 59 y 61 del exón 3; y los codones 117 y 146 del exón 4), la mediana de SG fue de 33,1 meses (IC 95 %, 24,5–39,4) en el grupo de cetuximab en comparación con 25,0 meses (IC 95 %, 23,0–28,1) en el grupo de bevacizumab (CRI, 0,70; IC 95 %, 0,54–0,90; P = 0,0059).
- Cabe destacar que, solo el 52 % de los pacientes asignados al grupo de bevacizumab recibieron después cetuximab o panitumumab.
- El Cancer and Leukemia Group B presentó el estudio intergrupal 80405 [NCT00265850] en la reunión de la ASCO de 2014. En este estudio se asignó al azar a 2334 pacientes de cáncer con KRAS natural que no se habían tratado antes para recibir quimioterapia (FOLFOX o FOLFIRI) y bevacizumab, o quimioterapia y cetuximab. La SG fue el criterio principal de valoración.[Nivel de evidencia B1]
- No hubo diferencia estadísticamente significativa en la SG entre los pacientes asignados a bevacizumab o cetuximab (las diferencias de SG según la quimioterapia fueron las siguientes: 29,04 [25,66–31,21] meses para el bevacizumab vs. 29,93 [27,56–31,21] meses para el bevacizumab; CRI, 0,92 [0,78–1,09]; P = 0,34).
A partir de estos dos estudios se concluyó que no hay una diferencia bien delimitada y significativa en iniciar el tratamiento con quimioterapia y bevacizumab o cetuximab para pacientes de cáncer colorrectal metastásico que expresan KRAS natural. No obstante, en los pacientes de cáncer con KRAS natural, la administración de un anticuerpo anti-EGFR durante el tratamiento mejora la SG.
Regorafenib
El regorafenib es un inhibidor de múltiples vías de tirosina–cinasas, como el VEGF. En septiembre de 2012, la FDA aprobó (ver documento en inglés) el uso de regorafenib en pacientes cuya enfermedad había progresado durante tratamientos previos.
Datos probatorios (regorafenib):
- La inocuidad y eficacia del regorafenib se evaluó en un solo estudio clínico de 760 pacientes de cáncer colorrectal metastásico sometidos a tratamiento previo. Se asignó al azar a los pacientes en una proporción 2:1 para recibir regorafenib o un placebo además del mejor cuidado de apoyo.
- Los pacientes tratados con regorafenib presentaron una mejora estadísticamente significativa de la SG (6,4 meses en el grupo de regorafenib vs. 5,0 meses en el grupo de placebo; CRI, 0,77; IC 95 %, 0,64–0,94; P unilateral = 0,0052).
TAS-102
El TAS-102 (Lonsurf) es una combinación de administración oral de trifluridina (un análogo del nucleósido timidina) y clorhidrato de tipiracilo (un inhibidor de la timidina fosforilasa). La trifluridina, en su forma de trifosfato inhibe la timidilato sintasa; por lo tanto, esta forma de trifluridina tiene efecto antitumoral. El clorhidrato de tipiracilo es un inhibidor potente de la timidina fosforilasa, que degrada la trifluridina de manera activa. La combinación de trifluridina y tipiracilo hace posible que se mantengan suficientes concentraciones plasmáticas de trifluridina.
Datos probatorios (TAS-102):
- En un estudio con enmascaramiento doble de fase III (RECOURSE [NCT01607957]), se asignó al azar a 800 pacientes con cáncer colorrectal en estadio IV cuyo cáncer fue resistente al tratamiento con dos terapias previas. Era necesario que los pacientes hubieran recibido 5-FU, oxaliplatino, irinotecán y bevacizumab; además, para los casos de cánceres que expresaban KRAS natural, era necesario que hubieran recibido cetuximab o panitumumab. Se asignó al azar a los pacientes en una proporción de 2:1 para recibir el mejor cuidado médico de apoyo con TAS-102 (n = 534) o placebo (n = 266). La mediana de edad de los pacientes fue de 63 años y la mayoría de los pacientes (60–63 %) había recibido tratamiento de cuarta línea o adicional. Todos los pacientes recibieron antes una fluoropirimidina, irinotecán, oxaliplatino y bevacizumab; además, el 52 % de los pacientes recibió un inhibidor de EGFR. Aproximadamente el 20 % de los pacientes había recibido tratamiento con regorafenib.[Nivel de evidencia A1]
- Se administró TAS-102 combinado con los alimentos en dosis de 35 mg/m2 2 veces al día por 5 días, con 2 días de descanso semanales durante 2 semanas, seguidos de 14 días de descanso farmacológico.
- El criterio principal de valoración del estudio fue la SG. La mediana de SG para los pacientes de cáncer colorrectal metastásico que recibieron TAS-102 fue de 7,1 meses en comparación con 5,3 meses para quienes recibieron un placebo (CRI, 0,68; P< 0,0001).
- La mediana de SSP en el grupo de TAS-102 fue de 2 versus 1,7 meses en el grupo de placebo (CRI, 0,48; P< 0,0001).
- Los criterios secundarios de valoración fueron la SSP, la tasa de respuesta general y la tasa de control de la enfermedad.
- La tasa de respuesta general fue del 1,6 % con TAS-102, que abarcó una respuesta completa en un paciente y respuestas parciales en otros pacientes. La tasa de respuesta general con el placebo fue del 0,4 % (P = 0,29).
La FDA aprobó el TAS-102 para el tratamiento de los pacientes con cáncer colorrectal metastásico a partir de los resultados del ensayo RECOURSE.
Encorafenib con cetuximab para pacientes con mutaciones V600E en BRAF
Las mutaciones V600E en BRAF se producen en alrededor del 10 % de los cánceres colorrectales metastásicos y son un indicador de un pronóstico precario. A diferencia del melanoma, la monoterapia con un inhibidor de BRAF no ha demostrado ser beneficiosa para el cáncer colorrectal, y varios estudios han evaluado el tratamiento simultáneo dirigido a la vía EGFR-MAPK.
Datos probatorios (encorafenib con cetuximab para pacientes con mutaciones V600E en BRAF):
- Encorafenib (inhibidor de BRAF), binimetinib (inhibidor de MEK) y cetuximab (inhibidor de EGFR):
en el ensayo international, sin anonimato y aleatorizado de fase III BEACON, se inscribieron pacientes con cáncer colorrectal metastásico y mutaciones V600E en BRAF que recibieron antes uno o dos regímenes de tratamiento. En el ensayo se asignaron al azar 665 pacientes en una proporción 1:1:1 para recibir uno de los siguientes tratamientos:
- Tratamiento triple: encorafenib (300 mg al día por VO), binimetinib (45 mg 2 veces al día por VO) y cetuximab (dosis de carga de 400 mg/m2 IV seguida de 250 mg/m2 IV cada semana) (n = 224).
- Tratamiento doble: encorafenib y cetuximab (según la dosis del tratamiento triple) (n = 220).
- Grupo de control: FOLFIRI o irinotecán (cada 2 semanas) con cetuximab (dosis de carga de 400 mg/m2 IV seguida de 250 mg/m2 IV cada semana) (n = 221).
Los criterios principales de valoración fueron la SG y la respuesta objetiva en el grupo del tratamiento triple en comparación con el grupo de control.
- La SG fue de 9,0 meses en el grupo de tratamiento triple y de 5,4 meses en el grupo de control (CRI, 0,52; IC 95 %, 0,39–0,70, P< 0,0001).[Nivel de evidencia A1]
- En el 58 % de los pacientes en el grupo de tratamiento triple, se presentaron efectos secundarios de grado 3 o más alto; el 10 % de los pacientes presentó diarrea y el 11 % anemia. En el 50 % de los pacientes en el grupo de tratamiento doble y en el 61 % del grupo de control, se presentaron efectos secundarios de grado 3 o más alto. El 14 % de los pacientes que recibieron el régimen doble presentaron nevos melanocíticos.
En mayo de 2020, se presentaron datos actualizados en forma de resumen:
- La mediana de SG para los grupos de tratamiento triple y doble fue de 9,3 meses y para el grupo de control fue de 5,9 meses (CRI, 0,60 para el grupo de tratamiento triple vs. grupo de control; IC 95 %, 0,47–0,75; CRI, 0,61 para el grupo de tratamiento doble vs. grupo de control; IC 95 %, 0,48–0,77).
- La tasa de respuesta objetiva para los pacientes que recibieron el tratamiento triple fue del 26,8 % (IC 95 %, 21,1–33,1 %) y del 19,5 % para los pacientes que recibieron el tratamiento doble (IC 95 %, 14,5–25,4 %).
De acuerdo con estos datos, en abril de 2020 la FDA aprobó la combinación de encorafenib con cetuximab para los pacientes que recibieron tratamiento previo para el cáncer de colon metastásico con mutaciones V600E en BRAF.
Inmunoterapia
Alrededor del 4 % de los pacientes con cáncer colorrectal en estadio IV tienen tumores con deficiencia en la reparación de errores de emparejamiento (dMMR) o con microsatélites inestables, lo que también se conoce como inestabilidad microsatelital alta (IMS-A). El fenotipo IMS-A se relaciona con defectos en la línea germinal de los genes MLH1, MSH2, MSH6 y PMS2 y es el fenotipo principal que se observa en tumores de pacientes con cáncer colorrectal sin poliposis hereditario (HNPCC) o síndrome de Lynch. También es posible que los pacientes presenten el fenotipo IMS-A debido al silenciamiento de uno de los genes por un proceso llamado metilación del DNA. La evaluación de la inestabilidad microsatelital se realiza mediante pruebas genéticas moleculares que determinan la inestabilidad microsatelital en el tejido tumoral o mediante análisis inmunohistoquímico que detecta la ausencia de proteínas de reparación de errores de emparejamiento. El estado de IMS-A ha tenido históricamente un pronóstico de mayor supervivencia para los pacientes con enfermedad en etapas tempranas y, desde 2015, también se ha encontrado que predice la respuesta del tumor a la inhibición de puntos de control.
En junio de 2020, la FDA aprobó el uso de pembrolizumab en pacientes con cáncer colorrectal metastásico con dMMR o IMS-A sin tratamiento previo. Se encuentran en curso estudios sobre el tratamiento de primera línea con inhibidores duales de puntos de control. En mayo de 2017, la FDA aprobó el uso de pembrolizumab, un anticuerpo de la proteína de muerte celular programada 1 (PD-1), y en julio de 2017 aprobó el uso de nivolumab para el tratamiento de pacientes con tumores con inestabilidad microsatelital que recibieron tratamiento a base de 5-FU, oxaliplatino e irinotecán. En julio de 2018, la FDA concedió la aprobación acelerada para la combinación de nivolumab con ipilimumab (inhibidor de CTLA-4) para tratar el cáncer colorrectal con IMS-A que progresó después de tratamientos previos a base de 5-FU, oxaliplatino e irinotecán.
Inmunoterapia de primera línea
Pembrolizumab en monoterapia
Datos probatorios (pembrolizumab en monoterapia):
- En el ensayo internacional de fase III, sin anonimato, aleatorizado KEYNOTE-177 (NCT02563002), se asignaron al azar 307 pacientes con cáncer colorrectal metástasico con IMS-A o dMMR sin tratamiento previo en una proporción 1:1 para recibir pembrolizumab (200 mg cada 3 semanas) o quimioterapia (FOLFIRI o FOLFOX-6 modificada, con bevacizumab o cetuximab o sin estos).
- La mediana de SSP fue de 16,5 meses para los pacientes que recibieron pembrolizumab y de 8,2 meses para los pacientes que recibieron quimioterapia (CRI, 0,60; IC 95 %, 0,45–0,80; P = 0,0002).[Nivel de evidencia A3]
- La SSP en los subgrupos predeterminados demostró un CRI que favoreció al grupo del pembrolizumab, excepto en pacientes con mutaciones en KRAS/NRAS.
- La tasa de respuesta objetiva fue del 43,8 % en el grupo de pembrolizumab y del 33,3 % en el grupo de quimioterapia. La mediana de la duración de la respuesta no se alcanzó en el grupo de pembrolizumab (intervalo, 2,3–41,4 meses) y fue de 10,6 meses en el grupo de quimioterapia (intervalo, 2,8–37,5 meses).
- En el 56 % de los pacientes que recibieron pembrolizumab se presentaron efectos adversos de grado 3 o más alto (un 9 % presentó efectos adversos de grado 3 o más alto relacionados con la infusión), en comparación con el 78 % de los pacientes que recibieron quimioterapia.
- Una revisión final de la SG, presentada en forma de resumen, mostró que no se alcanzó la mediana de SG en el grupo de pembrolizumab y fue de 36,7 meses en el grupo de quimioterapia (CRI, 0,74; IC 95 %, 0,53–1,03; P = 0,0359).
Nivolumab e ipilimumab
Datos probatorios (nivolumab e ipilimumab):
- En una cohorte de grupo único del estudio multicéntrico de fase II CheckMate-142 (NCT02060188) presentado en forma de resumen, se administró nivolumab (3 mg/kg cada 2 semanas) con ipilimumab (1 mg/kg cada 6 semanas) a 45 pacientes de cáncer colorrectal metastásico con IMS-A o dMMR sin tratamiento previo. El criterio principal de valoración fue la tasa de respuesta objetiva.
- La tasa de respuesta objetiva fue del 69 % entre los pacientes inscritos y del 80 % para los pacientes con mutaciones en KRAS (n = 10).[Nivel de evidencia C2]
- En un seguimiento médico a los 2 años, no se alcanzó la mediana de SSP ni de SG.
Inmunoterapia de segunda línea
Pembrolizumab en monoterapia
Datos probatorios (pembrolizumab en monoterapia):
- La aprobación de la FDA para el pembrolizumab en monoterapia se sustentó en datos de 149 pacientes con IMS-A o cánceres con dMMR inscritos en 5 ensayos clínicos de un solo grupo, multicéntricos, multicohortes y no controlados. De los pacientes, 90 tenían cáncer colorrectal y 59 tenían un diagnóstico de 1 de 14 tipos de cáncer. Los pacientes recibieron 200 mg de pembrolizumab cada 3 semanas o 10 mg/kg de pembrolizumab cada 2 semanas. El tratamiento continuó hasta que se presentó una concentración tóxica inaceptable o progresión de la enfermedad. Las medidas principales de los resultados de eficacia fueron la tasa de respuesta objetiva (evaluada mediante revisión central independiente y enmascarada hecha por radiólogos según los Response Evaluation Criteria in Solid Tumors [RECIST] 1.1) y la duración de la respuesta.
- La tasa de respuesta objetiva fue del 39,6 % (IC 95 %, 31,7–47,9 %).
- Las respuestas duraron 6 meses o más para el 78 % de los pacientes que respondieron al pembrolizumab. Hubo 11 respuestas completas y 48 respuestas parciales.
- La tasa de respuesta objetiva fue similar para los pacientes con diagnóstico de cáncer colorrectal (36 %) y aquellos con otros cánceres (46 % para los otros 14 tipos de cáncer).
Nivolumab en monoterapia
Datos probatorios (nivolumab en monoterapia):
- En el ensayo CheckMate-142 (NCT02060188), se inscribieron 74 pacientes con cáncer colorrectal con dMMR o IMS-A y tratamiento previo en un estudio sin enmascaramiento de grupo único y de fase II para recibir nivolumab (3 mg/kg cada 2 semanas). El criterio principal de valoración fue la respuesta objetiva según RECIST 1.1.
- La tasa de respuesta objetiva fue del 31,1 % (IC 95 %, 20,8–42,9 %).
- Se presentaron efectos adversos de grado 3 a 4 relacionados con el tratamiento en el 21 % de los pacientes.
Nivolumab e ipilimumab
Datos probatorios (nivolumab e ipilimumab):
- El ensayo multicéntrico sin anonimato de fase II CheckMate-142 (NCT02060188) se realizó con una cohorte de pacientes con cáncer colorrectal recurrente o metastásico con dMMR o IMS-A que progresaron, eran intolerantes, o declinaron al menos una línea de quimioterapia (incluso 5-FU y oxaliplatino o irinotecán). En el ensayo se inscribieron 119 pacientes que recibieron 4 dosis de nivolumab (3 mg/kg) e ipilimumab (1 mg/kg) cada 3 semanas (inducción), y luego nivolumab (3 mg/kg IV) cada 2 semanas (mantenimiento). El criterio principal de valoración fue la tasa de respuesta objetiva.
- La tasa de respuesta objetiva fue del 55 % (IC 95 %, 45,2–63,8 %).
- Entre los pacientes que presentaron una respuesta, el 83 % tuvieron respuestas que duraron más de 6 meses.
- Se presentaron efectos adversos de grado 3 a 4 relacionados con el tratamiento en el 32 % de los pacientes.
Opciones de tratamiento en evaluación clínica
Las opciones de tratamiento en evaluación clínica para el cáncer de colon en estadio IV y recidivante son las siguientes:
- Participación en ensayos clínicos en los que se evalúan nuevos fármacos y terapias biológicas.
- Participación en ensayos clínicos en los que se comparan varios regímenes quimioterapéuticos o terapias biológicas, solos o en combinación.
Ensayos clínicos en curso
Realizar una búsqueda avanzada en inglés de los ensayos clínicos sobre cáncer auspiciados por el NCI que ahora aceptan pacientes. La búsqueda se puede simplificar por ubicación del ensayo, tipo de tratamiento, nombre del fármaco y otros criterios. También se dispone de información general sobre los ensayos clínicos.
References
- Serafini AN, Klein JL, Wolff BG, et al.: Radioimmunoscintigraphy of recurrent, metastatic, or occult colorectal cancer with technetium 99m-labeled totally human monoclonal antibody 88BV59: results of pivotal, phase III multicenter studies. J Clin Oncol 16 (5): 1777-87, 1998.
- Wagman LD, Kemeny MM, Leong L, et al.: A prospective, randomized evaluation of the treatment of colorectal cancer metastatic to the liver. J Clin Oncol 8 (11): 1885-93, 1990.
- Scheele J, Stangl R, Altendorf-Hofmann A: Hepatic metastases from colorectal carcinoma: impact of surgical resection on the natural history. Br J Surg 77 (11): 1241-6, 1990.
- Scheele J, Stangl R, Altendorf-Hofmann A, et al.: Indicators of prognosis after hepatic resection for colorectal secondaries. Surgery 110 (1): 13-29, 1991.
- Adson MA, van Heerden JA, Adson MH, et al.: Resection of hepatic metastases from colorectal cancer. Arch Surg 119 (6): 647-51, 1984.
- Coppa GF, Eng K, Ranson JH, et al.: Hepatic resection for metastatic colon and rectal cancer. An evaluation of preoperative and postoperative factors. Ann Surg 202 (2): 203-8, 1985.
- Gayowski TJ, Iwatsuki S, Madariaga JR, et al.: Experience in hepatic resection for metastatic colorectal cancer: analysis of clinical and pathologic risk factors. Surgery 116 (4): 703-10; discussion 710-1, 1994.
- Fernández-Trigo V, Shamsa F, Sugarbaker PH: Repeat liver resections from colorectal metastasis. Repeat Hepatic Metastases Registry. Surgery 117 (3): 296-304, 1995.
- Jaeck D, Bachellier P, Guiguet M, et al.: Long-term survival following resection of colorectal hepatic metastases. Association Française de Chirurgie. Br J Surg 84 (7): 977-80, 1997.
- Taylor M, Forster J, Langer B, et al.: A study of prognostic factors for hepatic resection for colorectal metastases. Am J Surg 173 (6): 467-71, 1997.
- Elias D, Cavalcanti A, Sabourin JC, et al.: Resection of liver metastases from colorectal cancer: the real impact of the surgical margin. Eur J Surg Oncol 24 (3): 174-9, 1998.
- Girard P, Ducreux M, Baldeyrou P, et al.: Surgery for lung metastases from colorectal cancer: analysis of prognostic factors. J Clin Oncol 14 (7): 2047-53, 1996.
- Hughes KS, Simon R, Songhorabodi S, et al.: Resection of the liver for colorectal carcinoma metastases: a multi-institutional study of patterns of recurrence. Surgery 100 (2): 278-84, 1986.
- Schlag P, Hohenberger P, Herfarth C: Resection of liver metastases in colorectal cancer--competitive analysis of treatment results in synchronous versus metachronous metastases. Eur J Surg Oncol 16 (4): 360-5, 1990.
- Rosen CB, Nagorney DM, Taswell HF, et al.: Perioperative blood transfusion and determinants of survival after liver resection for metastatic colorectal carcinoma. Ann Surg 216 (4): 493-504; discussion 504-5, 1992.
- Fong Y, Fortner J, Sun RL, et al.: Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases. Ann Surg 230 (3): 309-18; discussion 318-21, 1999.
- Leonard GD, Brenner B, Kemeny NE: Neoadjuvant chemotherapy before liver resection for patients with unresectable liver metastases from colorectal carcinoma. J Clin Oncol 23 (9): 2038-48, 2005.
- Rossi S, Buscarini E, Garbagnati F, et al.: Percutaneous treatment of small hepatic tumors by an expandable RF needle electrode. AJR Am J Roentgenol 170 (4): 1015-22, 1998.
- Solbiati L, Livraghi T, Goldberg SN, et al.: Percutaneous radio-frequency ablation of hepatic metastases from colorectal cancer: long-term results in 117 patients. Radiology 221 (1): 159-66, 2001.
- Lencioni R, Goletti O, Armillotta N, et al.: Radio-frequency thermal ablation of liver metastases with a cooled-tip electrode needle: results of a pilot clinical trial. Eur Radiol 8 (7): 1205-11, 1998.
- Curley SA, Izzo F, Delrio P, et al.: Radiofrequency ablation of unresectable primary and metastatic hepatic malignancies: results in 123 patients. Ann Surg 230 (1): 1-8, 1999.
- Oshowo A, Gillams A, Harrison E, et al.: Comparison of resection and radiofrequency ablation for treatment of solitary colorectal liver metastases. Br J Surg 90 (10): 1240-3, 2003.
- Livraghi T, Solbiati L, Meloni F, et al.: Percutaneous radiofrequency ablation of liver metastases in potential candidates for resection: the "test-of-time approach". Cancer 97 (12): 3027-35, 2003.
- Pawlik TM, Izzo F, Cohen DS, et al.: Combined resection and radiofrequency ablation for advanced hepatic malignancies: results in 172 patients. Ann Surg Oncol 10 (9): 1059-69, 2003.
- Jarnagin WR, Fong Y, Ky A, et al.: Liver resection for metastatic colorectal cancer: assessing the risk of occult irresectable disease. J Am Coll Surg 188 (1): 33-42, 1999.
- Ravikumar TS, Kaleya R, Kishinevsky A: Surgical ablative therapy of liver tumors. Cancer: Principles and Practice of Oncology Updates 14 (3): 1-12, 2000.
- Seifert JK, Morris DL: Prognostic factors after cryotherapy for hepatic metastases from colorectal cancer. Ann Surg 228 (2): 201-8, 1998.
- Bageacu S, Kaczmarek D, Lacroix M, et al.: Cryosurgery for resectable and unresectable hepatic metastases from colorectal cancer. Eur J Surg Oncol 33 (5): 590-6, 2007.
- Thomas DS, Nauta RJ, Rodgers JE, et al.: Intraoperative high-dose rate interstitial irradiation of hepatic metastases from colorectal carcinoma. Results of a phase I-II trial. Cancer 71 (6): 1977-81, 1993.
- Ravikumar TS: Interstitial therapies for liver tumors. Surg Oncol Clin N Am 5 (2): 365-77, 1996.
- McAfee MK, Allen MS, Trastek VF, et al.: Colorectal lung metastases: results of surgical excision. Ann Thorac Surg 53 (5): 780-5; discussion 785-6, 1992.
- Headrick JR, Miller DL, Nagorney DM, et al.: Surgical treatment of hepatic and pulmonary metastases from colon cancer. Ann Thorac Surg 71 (3): 975-9; discussion 979-80, 2001.
- Portier G, Elias D, Bouche O, et al.: Multicenter randomized trial of adjuvant fluorouracil and folinic acid compared with surgery alone after resection of colorectal liver metastases: FFCD ACHBTH AURC 9002 trial. J Clin Oncol 24 (31): 4976-82, 2006.
- Mitry E, Fields AL, Bleiberg H, et al.: Adjuvant chemotherapy after potentially curative resection of metastases from colorectal cancer: a pooled analysis of two randomized trials. J Clin Oncol 26 (30): 4906-11, 2008.
- Ychou M, Hohenberger W, Thezenas S, et al.: A randomized phase III study comparing adjuvant 5-fluorouracil/folinic acid with FOLFIRI in patients following complete resection of liver metastases from colorectal cancer. Ann Oncol 20 (12): 1964-70, 2009.
- Nordlinger B, Sorbye H, Glimelius B, et al.: Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial. Lancet 371 (9617): 1007-16, 2008.
- Kemeny N, Daly J, Reichman B, et al.: Intrahepatic or systemic infusion of fluorodeoxyuridine in patients with liver metastases from colorectal carcinoma. A randomized trial. Ann Intern Med 107 (4): 459-65, 1987.
- Chang AE, Schneider PD, Sugarbaker PH, et al.: A prospective randomized trial of regional versus systemic continuous 5-fluorodeoxyuridine chemotherapy in the treatment of colorectal liver metastases. Ann Surg 206 (6): 685-93, 1987.
- Rougier P, Laplanche A, Huguier M, et al.: Hepatic arterial infusion of floxuridine in patients with liver metastases from colorectal carcinoma: long-term results of a prospective randomized trial. J Clin Oncol 10 (7): 1112-8, 1992.
- Kemeny N, Cohen A, Seiter K, et al.: Randomized trial of hepatic arterial floxuridine, mitomycin, and carmustine versus floxuridine alone in previously treated patients with liver metastases from colorectal cancer. J Clin Oncol 11 (2): 330-5, 1993.
- Reappraisal of hepatic arterial infusion in the treatment of nonresectable liver metastases from colorectal cancer. Meta-Analysis Group in Cancer. J Natl Cancer Inst 88 (5): 252-8, 1996.
- Mocellin S, Pilati P, Lise M, et al.: Meta-analysis of hepatic arterial infusion for unresectable liver metastases from colorectal cancer: the end of an era? J Clin Oncol 25 (35): 5649-54, 2007.
- Kemeny N, Huang Y, Cohen AM, et al.: Hepatic arterial infusion of chemotherapy after resection of hepatic metastases from colorectal cancer. N Engl J Med 341 (27): 2039-48, 1999.
- Kemeny MM, Adak S, Gray B, et al.: Combined-modality treatment for resectable metastatic colorectal carcinoma to the liver: surgical resection of hepatic metastases in combination with continuous infusion of chemotherapy--an intergroup study. J Clin Oncol 20 (6): 1499-505, 2002.
- Petrelli N, Herrera L, Rustum Y, et al.: A prospective randomized trial of 5-fluorouracil versus 5-fluorouracil and high-dose leucovorin versus 5-fluorouracil and methotrexate in previously untreated patients with advanced colorectal carcinoma. J Clin Oncol 5 (10): 1559-65, 1987.
- Petrelli N, Douglass HO, Herrera L, et al.: The modulation of fluorouracil with leucovorin in metastatic colorectal carcinoma: a prospective randomized phase III trial. Gastrointestinal Tumor Study Group. J Clin Oncol 7 (10): 1419-26, 1989.
- Scheithauer W, Rosen H, Kornek GV, et al.: Randomised comparison of combination chemotherapy plus supportive care with supportive care alone in patients with metastatic colorectal cancer. BMJ 306 (6880): 752-5, 1993.
- Expectancy or primary chemotherapy in patients with advanced asymptomatic colorectal cancer: a randomized trial. Nordic Gastrointestinal Tumor Adjuvant Therapy Group. J Clin Oncol 10 (6): 904-11, 1992.
- Buyse M, Thirion P, Carlson RW, et al.: Relation between tumour response to first-line chemotherapy and survival in advanced colorectal cancer: a meta-analysis. Meta-Analysis Group in Cancer. Lancet 356 (9227): 373-8, 2000.
- Leichman CG, Fleming TR, Muggia FM, et al.: Phase II study of fluorouracil and its modulation in advanced colorectal cancer: a Southwest Oncology Group study. J Clin Oncol 13 (6): 1303-11, 1995.
- Van Cutsem E, Twelves C, Cassidy J, et al.: Oral capecitabine compared with intravenous fluorouracil plus leucovorin in patients with metastatic colorectal cancer: results of a large phase III study. J Clin Oncol 19 (21): 4097-106, 2001.
- Hoff PM, Ansari R, Batist G, et al.: Comparison of oral capecitabine versus intravenous fluorouracil plus leucovorin as first-line treatment in 605 patients with metastatic colorectal cancer: results of a randomized phase III study. J Clin Oncol 19 (8): 2282-92, 2001.
- Saltz LB, Cox JV, Blanke C, et al.: Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. Irinotecan Study Group. N Engl J Med 343 (13): 905-14, 2000.
- de Gramont A, Figer A, Seymour M, et al.: Leucovorin and fluorouracil with or without oxaliplatin as first-line treatment in advanced colorectal cancer. J Clin Oncol 18 (16): 2938-47, 2000.
- Douillard JY, Cunningham D, Roth AD, et al.: Irinotecan combined with fluorouracil compared with fluorouracil alone as first-line treatment for metastatic colorectal cancer: a multicentre randomised trial. Lancet 355 (9209): 1041-7, 2000.
- Tournigand C, André T, Achille E, et al.: FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol 22 (2): 229-37, 2004.
- Colucci G, Gebbia V, Paoletti G, et al.: Phase III randomized trial of FOLFIRI versus FOLFOX4 in the treatment of advanced colorectal cancer: a multicenter study of the Gruppo Oncologico Dell'Italia Meridionale. J Clin Oncol 23 (22): 4866-75, 2005.
- Fuchs CS, Marshall J, Mitchell E, et al.: Randomized, controlled trial of irinotecan plus infusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: results from the BICC-C Study. J Clin Oncol 25 (30): 4779-86, 2007.
- Díaz-Rubio E, Tabernero J, Gómez-España A, et al.: Phase III study of capecitabine plus oxaliplatin compared with continuous-infusion fluorouracil plus oxaliplatin as first-line therapy in metastatic colorectal cancer: final report of the Spanish Cooperative Group for the Treatment of Digestive Tumors Trial. J Clin Oncol 25 (27): 4224-30, 2007.
- Porschen R, Arkenau HT, Kubicka S, et al.: Phase III study of capecitabine plus oxaliplatin compared with fluorouracil and leucovorin plus oxaliplatin in metastatic colorectal cancer: a final report of the AIO Colorectal Study Group. J Clin Oncol 25 (27): 4217-23, 2007.
- Rothenberg ML, Eckardt JR, Kuhn JG, et al.: Phase II trial of irinotecan in patients with progressive or rapidly recurrent colorectal cancer. J Clin Oncol 14 (4): 1128-35, 1996.
- Conti JA, Kemeny NE, Saltz LB, et al.: Irinotecan is an active agent in untreated patients with metastatic colorectal cancer. J Clin Oncol 14 (3): 709-15, 1996.
- Rougier P, Van Cutsem E, Bajetta E, et al.: Randomised trial of irinotecan versus fluorouracil by continuous infusion after fluorouracil failure in patients with metastatic colorectal cancer. Lancet 352 (9138): 1407-12, 1998.
- Cunningham D, Pyrhönen S, James RD, et al.: Randomised trial of irinotecan plus supportive care versus supportive care alone after fluorouracil failure for patients with metastatic colorectal cancer. Lancet 352 (9138): 1413-8, 1998.
- Rothenberg ML, Oza AM, Bigelow RH, et al.: Superiority of oxaliplatin and fluorouracil-leucovorin compared with either therapy alone in patients with progressive colorectal cancer after irinotecan and fluorouracil-leucovorin: interim results of a phase III trial. J Clin Oncol 21 (11): 2059-69, 2003.
- Hurwitz H, Fehrenbacher L, Novotny W, et al.: Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 350 (23): 2335-42, 2004.
- Sanoff HK, Sargent DJ, Campbell ME, et al.: Five-year data and prognostic factor analysis of oxaliplatin and irinotecan combinations for advanced colorectal cancer: N9741. J Clin Oncol 26 (35): 5721-7, 2008.
- Saltz LB, Clarke S, Díaz-Rubio E, et al.: Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol 26 (12): 2013-9, 2008.
- Cassidy J, Clarke S, Díaz-Rubio E, et al.: Randomized phase III study of capecitabine plus oxaliplatin compared with fluorouracil/folinic acid plus oxaliplatin as first-line therapy for metastatic colorectal cancer. J Clin Oncol 26 (12): 2006-12, 2008.
- Giantonio BJ, Catalano PJ, Meropol NJ, et al.: High-dose bevacizumab improves survival when combined with FOLFOX4 in previously treated advanced colorectal cancer: results from the Eastern Cooperative Oncology Group (ECOG) study E3200. [Abstract] J Clin Oncol 23 (Suppl 16): A-2, 1s, 2005.
- Arnold D, Andre T, Bennouna J, et al.: Bevacizumab (BEV) plus chemotherapy (CT) continued beyond first progression in patients with metastatic colorectal cancer (mCRC) previously treated with BEV plus CT: results of a randomized phase III intergroup study (TML study). [Abstract] J Clin Oncol 30 (Suppl 15): A-CRA3503, 2012.
- Loupakis F, Cremolini C, Masi G, et al.: Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med 371 (17): 1609-18, 2014.
- Cunningham D, Humblet Y, Siena S, et al.: Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med 351 (4): 337-45, 2004.
- Van Cutsem E, Köhne CH, Hitre E, et al.: Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med 360 (14): 1408-17, 2009.
- Tol J, Koopman M, Cats A, et al.: Chemotherapy, bevacizumab, and cetuximab in metastatic colorectal cancer. N Engl J Med 360 (6): 563-72, 2009.
- Maughan TS, Adams RA, Smith CG, et al.: Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet 377 (9783): 2103-14, 2011.
- Adams RA, Meade AM, Seymour MT, et al.: Intermittent versus continuous oxaliplatin and fluoropyrimidine combination chemotherapy for first-line treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet Oncol 12 (7): 642-53, 2011.
- Bokemeyer C, Cutsem EV, Rougier P, et al.: Addition of cetuximab to chemotherapy as first-line treatment for KRAS wild-type metastatic colorectal cancer: pooled analysis of the CRYSTAL and OPUS randomised clinical trials. Eur J Cancer 48 (10): 1466-75, 2012.
- Van Cutsem E, Tabernero J, Lakomy R, et al.: Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol 30 (28): 3499-506, 2012.
- Tabernero J, Yoshino T, Cohn AL, et al.: Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol 16 (5): 499-508, 2015.
- Van Cutsem E, Peeters M, Siena S, et al.: Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol 25 (13): 1658-64, 2007.
- Douillard JY, Siena S, Cassidy J, et al.: Randomized, phase III trial of panitumumab with infusional fluorouracil, leucovorin, and oxaliplatin (FOLFOX4) versus FOLFOX4 alone as first-line treatment in patients with previously untreated metastatic colorectal cancer: the PRIME study. J Clin Oncol 28 (31): 4697-705, 2010.
- Douillard JY, Oliner KS, Siena S, et al.: Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med 369 (11): 1023-34, 2013.
- Hecht JR, Mitchell E, Chidiac T, et al.: A randomized phase IIIB trial of chemotherapy, bevacizumab, and panitumumab compared with chemotherapy and bevacizumab alone for metastatic colorectal cancer. J Clin Oncol 27 (5): 672-80, 2009.
- Peeters M, Price TJ, Cervantes A, et al.: Randomized phase III study of panitumumab with fluorouracil, leucovorin, and irinotecan (FOLFIRI) compared with FOLFIRI alone as second-line treatment in patients with metastatic colorectal cancer. J Clin Oncol 28 (31): 4706-13, 2010.
- Heinemann V, von Weikersthal LF, Decker T, et al.: FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial. Lancet Oncol 15 (10): 1065-75, 2014.
- Venook AP, Niedzwiecki D, Lenz HJ, et al.: CALGB/SWOG 80405: Phase III trial of irinotecan/5-FU/leucovorin (FOLFIRI) or oxaliplatin/5-FU/leucovorin (mFOLFOX6) with bevacizumab (BV) or cetuximab (CET) for patients (pts) with KRAS wild-type (wt) untreated metastatic adenocarcinoma of the colon or rectum (MCRC). [Abstract] J Clin Oncol 32 (Suppl 5): A-LBA3, 2014.
- Stintzing S, Modest DP, Rossius L, et al.: FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab for metastatic colorectal cancer (FIRE-3): a post-hoc analysis of tumour dynamics in the final RAS wild-type subgroup of this randomised open-label phase 3 trial. Lancet Oncol 17 (10): 1426-1434, 2016.
- Modest DP, Stintzing S, von Weikersthal LF, et al.: Impact of Subsequent Therapies on Outcome of the FIRE-3/AIO KRK0306 Trial: First-Line Therapy With FOLFIRI Plus Cetuximab or Bevacizumab in Patients With KRAS Wild-Type Tumors in Metastatic Colorectal Cancer. J Clin Oncol 33 (32): 3718-26, 2015.
- Grothey A, Sobrero AF, Siena S, et al.: Results of a phase III randomized, double-blind, placebo-controlled, multicenter trial (CORRECT) of regorafenib plus best supportive care (BSC) versus placebo plus BSC in patients (pts) with metastatic colorectal cancer (mCRC) who have progressed after standard therapies. [Abstract] J Clin Oncol 30 (Suppl 4): A-LBA385, 2012.
- Grothey A, Van Cutsem E, Sobrero A, et al.: Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet 381 (9863): 303-12, 2013.
- Mayer RJ, Van Cutsem E, Falcone A, et al.: Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med 372 (20): 1909-19, 2015.
- Kopetz S, Grothey A, Yaeger R, et al.: Encorafenib, Binimetinib, and Cetuximab in BRAF V600E-Mutated Colorectal Cancer. N Engl J Med 381 (17): 1632-1643, 2019.
- Kopetz S, Grothey A, Van Cutsem E, et al.: Encorafenib plus cetuximab with or without binimetinib for BRAF V600E metastatic colorectal cancer: updated survival results from a randomized, three-arm, phase III study versus choice of either irinotecan or FOLFIRI plus cetuximab (BEACON CRC). [Abstract] J Clin Oncol 38 (15) (suppl): A-4001, 2020. Available online. Last accessed October 17, 2023.
- André T, Shiu KK, Kim TW, et al.: Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med 383 (23): 2207-2218, 2020.
- Andre T, Shiu K, Kim TW, et al.: Final overall survival for the phase III KN177 study: pembrolizumab versus chemotherapy in microsatellite instability-high/mismatch repair deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC). [Abstract] J Clin Oncol 39 (15) (suppl): A-3500, 2021. Available online. Last accessed October 17, 2023.
- Lenz H, Lonardi S, Zagonel V, et al.: Subgroup analyses of patients (pts) with microsatellite instability-high/mismatch repair-deficient (MSI-H/dMMR) metastatic colorectal cancer (mCRC) treated with nivolumab (NIVO) plus low-dose ipilimumab (IPI) as first-line (1L) therapy: two-year clinical update. [Abstract] J Clin Oncol 39 (3) (suppl): A-58, 2021. Available online. Last accessed October 17, 2023.
- Overman MJ, McDermott R, Leach JL, et al.: Nivolumab in patients with metastatic DNA mismatch repair-deficient or microsatellite instability-high colorectal cancer (CheckMate 142): an open-label, multicentre, phase 2 study. Lancet Oncol 18 (9): 1182-1191, 2017.
Actualizaciones más recientes a este resumen (01/17/2024)
Los resúmenes del PDQ con información sobre el cáncer se revisan con regularidad y se actualizan a medida que se obtiene nueva información. Esta sección describe los cambios más recientes introducidos en este resumen a partir de la fecha arriba indicada.
Se incorporaron cambios editoriales en este sumario.
El Consejo editorial del PDQ sobre el tratamiento para adultos es responsable de la redacción y actualización de este resumen y mantiene independencia editorial respecto del NCI. El resumen refleja una revisión independiente de la bibliografía médica y no representa las políticas del NCI ni de los NIH. Para obtener más información sobre las políticas relativas a los resúmenes y la función de los consejos editoriales del PDQ responsables de su actualización, consultar Información sobre este resumen del PDQ e Información del PDQ® sobre el cáncer dirigida a profesionales de la salud.
Información sobre este resumen del PDQ
Propósito de este resumen
Este resumen de información del PDQ sobre el cáncer dirigido a profesionales de la salud proporciona información integral revisada por expertos y basada en la evidencia sobre el tratamiento del cáncer de colon. El objetivo es servir como fuente de información y ayuda para los profesionales clínicos durante la atención de pacientes. No ofrece pautas ni recomendaciones formales para tomar decisiones relacionadas con la atención sanitaria.
Revisores y actualizaciones
El Consejo editorial del PDQ sobre el tratamiento para adultos, que mantiene independencia editorial respecto del Instituto Nacional del Cáncer (NCI), revisa este resumen de manera periódica y, en caso necesario, lo actualiza. Este resumen es el resultado de una revisión bibliográfica independiente y no constituye una declaración de política del NCI ni de los Institutos Nacionales de la Salud (NIH).
Cada mes, los integrantes de este consejo revisan los artículos publicados recientemente para determinar lo siguiente:
- Si el artículo se debe analizar en una reunión del consejo.
- Si conviene añadir texto acerca del artículo.
- Si se debe reemplazar o actualizar un artículo que ya se citó.
Los cambios en los resúmenes se deciden mediante consenso de los integrantes del consejo después de evaluar la solidez de la evidencia de los artículos publicados y determinar la forma de incorporar el artículo en el resumen.
Los revisores principales del sumario sobre Tratamiento del cáncer de colon son:
- Russell S. Berman, MD (New York University School of Medicine)
- Amit Chowdhry, MD, PhD (University of Rochester Medical Center)
- Valerie Lee, MD (Johns Hopkins University)
- Leon Pappas, MD, PhD (Dana-Farber Cancer Institute)
Cualquier comentario o pregunta sobre el contenido de este resumen se debe enviar al Servicio de Información de Cáncer del Instituto Nacional del Cáncer. Por favor, no enviar preguntas o comentarios directamente a los integrantes del consejo, ya que no responderán consultas de manera individual.
Niveles de evidencia
Algunas de las referencias bibliográficas de este resumen se acompañan del nivel de evidencia. El propósito de esto es ayudar al lector a evaluar la solidez de la evidencia que respalda el uso de ciertas intervenciones o abordajes. El Consejo editorial del PDQ sobre el tratamiento para adultos emplea un sistema de jerarquización formal para asignar los niveles de evidencia científica.
Permisos para el uso de este resumen
PDQ (Physician Data Query) es una marca registrada. Se autoriza el uso del texto de los documentos del PDQ; sin embargo, no se podrá identificar como un resumen de información sobre cáncer del PDQ del NCI, salvo que el resumen se reproduzca en su totalidad y se actualice de manera periódica. Por otra parte, se permitirá que un autor escriba una oración como “En el resumen del PDQ del NCI de información sobre la prevención del cáncer de mama se describen, de manera concisa, los siguientes riesgos: [incluir fragmento del resumen]”.
Se sugiere citar la referencia bibliográfica de este resumen del PDQ de la siguiente forma:
PDQ® sobre el tratamiento para adultos. PDQ Tratamiento del cáncer de colon. Bethesda, MD: National Cancer Institute. Actualización:
Las imágenes en este resumen se reproducen con autorización del autor, el artista o la editorial para uso exclusivo en los resúmenes del PDQ. La utilización de las imágenes fuera del PDQ requiere la autorización del propietario, que el Instituto Nacional del Cáncer no puede otorgar. Para obtener más información sobre el uso de las ilustraciones de este resumen o de otras imágenes relacionadas con el cáncer, consultar Visuals Online, una colección de más de 2000 imágenes científicas.
Cláusula sobre el descargo de responsabilidad
Según la solidez de la evidencia, las opciones de tratamiento se clasifican como “estándar” o “en evaluación clínica”. Estas clasificaciones no se deben utilizar para justificar decisiones sobre reembolsos de seguros. Para obtener más información sobre la cobertura de seguros, consultar la página Manejo de la atención del cáncer en Cancer.gov/espanol.
Comuníquese con el Instituto Nacional del Cáncer
Para obtener más información sobre las opciones para comunicarse con el NCI, incluso la dirección de correo electrónico, el número telefónico o el chat, consultar la página del Servicio de Información de Cáncer del Instituto Nacional del Cáncer.